题目内容
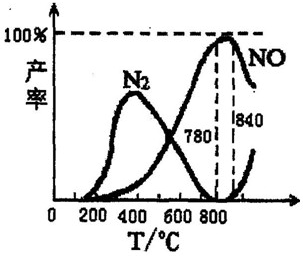 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图.
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图.①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ/mol
②4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ/mol
下列说法中不正确的是( )
| A、N2(g)+O2(g)?2NO(g);△H=+181.5 kJ/mol | B、加压有利于NH3生成NO,不利于NH3生成N2 | C、工业上氨催化氧化生成NO时,温度应控制在780~840℃之间 | D、工业上通常提高氧气的浓度,以提高NH3的转化率 |
分析:A.利用盖斯定律书写热化学方程式;
B.增大压强平衡向气体体积减小的方向移动;
C.从转化率的大小与温度的关系选择反应的适宜温度;
D.增大某一反应物的浓度,可以通过其它反应物的转化率.
B.增大压强平衡向气体体积减小的方向移动;
C.从转化率的大小与温度的关系选择反应的适宜温度;
D.增大某一反应物的浓度,可以通过其它反应物的转化率.
解答:解:A.根据盖斯定律,
(①-②)得N2(g)+O2(g)?2NO(g)△H=
[-905kJ/mol-(-1268kJ/mol
)]=+181.5kJ/mol,故A正确;
B.反应①、反应②正反应都是气体体积增大的反应,增大压强平衡都向逆反应方向移动,不利于NH3生成NO,不利于NH3生成N2,故B错误;
C.从图象可以看在,反应温度在在780~840℃之间,NO的产率最大,故C正确;
D.由于氧气比较经济容易获得,增大氧气的浓度平衡向正反应方向移动,工业上通常提高氧气的浓度,以提高NH3的转化率,故D正确;
故选:B.
| 1 |
| 2 |
| 1 |
| 2 |
)]=+181.5kJ/mol,故A正确;
B.反应①、反应②正反应都是气体体积增大的反应,增大压强平衡都向逆反应方向移动,不利于NH3生成NO,不利于NH3生成N2,故B错误;
C.从图象可以看在,反应温度在在780~840℃之间,NO的产率最大,故C正确;
D.由于氧气比较经济容易获得,增大氧气的浓度平衡向正反应方向移动,工业上通常提高氧气的浓度,以提高NH3的转化率,故D正确;
故选:B.
点评:本题考查化学平衡影响元素、反应热的计算等问题,难度不大,注意对题中图象的分析控制不同的温度获得不同的主要产物.

练习册系列答案
相关题目
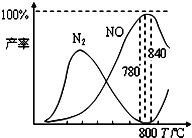 (2012?太原一模)氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生如下①主反应和②副反应:
(2012?太原一模)氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生如下①主反应和②副反应: 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图.4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1 ①4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ?mol-1 ②下列说法中正确的是( )
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图.4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1 ①4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ?mol-1 ②下列说法中正确的是( ) 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如右图。
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如右图。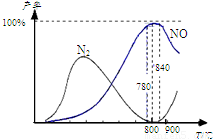
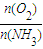 在1.7~2.0,主要是为了提高反应速率
在1.7~2.0,主要是为了提高反应速率