题目内容
【题目】环戊二烯(![]() )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:![]() (g) =
(g) = ![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1 ①,H2(g)+ I2(g) =2HI(g) ΔH2=11.0 kJ·mol 1 ②,对于反应
(g)+H2(g) ΔH1=100.3 kJ·mol 1 ①,H2(g)+ I2(g) =2HI(g) ΔH2=11.0 kJ·mol 1 ②,对于反应![]() (g)+ I2(g) =
(g)+ I2(g) =![]() (g)+2HI(g) ③ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ΔH3=___________kJ·mol 1。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了30%,环戊烯的转化率为___,该反应的平衡常数Kp=____Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有_____(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了30%,环戊烯的转化率为___,该反应的平衡常数Kp=____Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有_____(填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度 E.使用合适催化剂
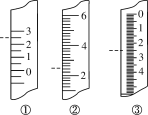
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是____(填标号)。

A.T1>T2 B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率 D.b点时二聚体的浓度为0.45 mol·L1
【答案】89.3 60% 2.7×105 BD CD
【解析】
(1)已知:![]() (g) =
(g) = ![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1 ①,H2(g)+ I2(g) =2HI(g) ΔH2=11.0 kJ·mol 1 ②,根据盖斯定律,①+②得③
(g)+H2(g) ΔH1=100.3 kJ·mol 1 ①,H2(g)+ I2(g) =2HI(g) ΔH2=11.0 kJ·mol 1 ②,根据盖斯定律,①+②得③![]() (g)+ I2(g) =
(g)+ I2(g) =![]() (g)+2HI(g),△H3=(+100.3kJ·mol-1)+(-11.0kJ·mol-1)=+89.3kJ·mol-1;
(g)+2HI(g),△H3=(+100.3kJ·mol-1)+(-11.0kJ·mol-1)=+89.3kJ·mol-1;
(2)设碘和环戊烯(![]() )的初始物质的量都为nmol,转化的物质的量为xmol,
)的初始物质的量都为nmol,转化的物质的量为xmol,
![]() (g) + I2(g) =
(g) + I2(g) = ![]() (g) + 2HI(g),
(g) + 2HI(g),
初始(mol) n n 0 0
转化(mol) x x x 2x
平衡(mol) n-x n-x x 2x
刚性容器内气体的压强与物质的量成正比,则:
(n-x+n-x+x+2x)mol/(n+n)mol=1+30%,解得:x=0.6n,
平衡时环戊烯的转化率为:0.6nmol/nmol×100%=60%;
平衡时混合气体的压强为:105Pa×(1+30%)=1.3×105Pa,混合气体总物质的量为:(n-0.6n+n-0.6n+0.6n+0.6n×2)mol=2.6nmol,
平衡时各组分所占压强分别为p(![]() )=p(I2)=(n-0.6n)mol÷2.6nmol×1.3×105Pa=2×104Pa,p(
)=p(I2)=(n-0.6n)mol÷2.6nmol×1.3×105Pa=2×104Pa,p(![]() )=0.6nmol÷2.6nmol×1.3×105Pa=3×104Pa,p(HI)=0.6nmol×2÷2.6nmol×1.3×105Pa=6×104Pa,该反应的平衡常数Kp=
)=0.6nmol÷2.6nmol×1.3×105Pa=3×104Pa,p(HI)=0.6nmol×2÷2.6nmol×1.3×105Pa=6×104Pa,该反应的平衡常数Kp=![]() ≈2.7×105Pa;
≈2.7×105Pa;
A.通入惰性气体,各组分浓度不变,平衡不移动,则环戊烯的转化率不变,故A错误;
B.该反应为吸热反应,提高温度平衡向着正向移动,环戊烯的转化率增大,故B正确;
C.增加环戊烯浓度,环戊烯的转化率减小,故C错误;
D.增加碘浓度,反应物浓度增大,平衡向着正向移动,环戊烯的转化率增大,故D正确;
E.使用合适催化剂,不能使平衡发生移动,故E错误;
故选BD;
(3)A.温度越高反应速率越快,根据图示可知,在温度T2(虚线)的反应速率较大,则T1<T2,故A错误;
B.根据图象可知,a点切线斜率的绝对值大于c点切线的绝对值,则a点速率大于c点,故B错误;
C.a到b的过程为正反应速率逐渐减小,且b点v(正)>v(逆),则a点的正反应速率大于b点的逆反应速率,故C正确;
D.b点时环戊二烯的浓度变化为:1.5mol·L-1-0.6mol·L-1=0.9mol·L-1,环戊二烯的二聚体的浓度为环戊二烯浓度变化的1/2,则b点时二聚体的浓度为0.9mol·L-1×1/2=0.45mol·L-1,故D正确;
故选CD。

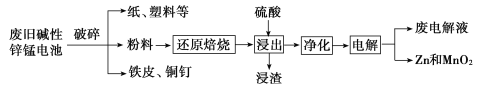
【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图所示。放电时总反应为:Zn+2H2O+2MnO2=Zn(OH)2+2MnOOH。
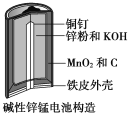
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如图所示:
回答下列问题:
(1)MnOOH中,Mn元素的化合价为_________。
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),主要原因是“粉料”中含有_________。
(3)“净化”是为了除去浸出液中的Fe2+,方法是:加入______(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+沉淀完全。常温下,已知浸出液中Mn2+、Zn2+的浓度约为0.1 mol/L,根据下列数据计算,调节pH的合理范围是______至__________。(离子浓度小于1×10-5 mol/L即为沉淀完全)
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
(4)“电解”时,阳极的电极反应式为_________。本工艺中应循环利用的物质是_______(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2,且生成一种黄绿色气体,“粉料”中的MnOOH与盐酸反应的化学方程式为__________。
【题目】某兴趣小组用粗CuO(仅含杂质FeO)制备氯化铜晶体(CuCl2·2H2O)并进一步测定纯度,具体流程如下:

相关信息如下:
①氯化铜从水溶液中结晶时,在15℃以下得到四水物,在15~25.7℃得到三水物,在26~42℃得到二水物,在42℃以上得到一水物,在100℃得到无水物。
②金属离子形成氢氧化物沉淀的pH范围。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Cu2+ | 5.2 | 6.4 |
(1)步骤II加入稍过量的双氧水的目的是___。
(2)步骤III,需要用到下列所有的操作:
a.用盐酸溶解 b.调pH=3.0 c.调pH=7.0 d.洗涤 e.过滤。
请给出上述操作的正确顺序________(操作可重复使用)。
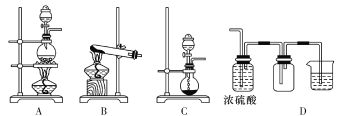
(3)步骤IV的装置图如图:
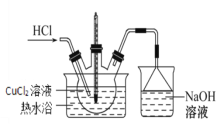
①持续通入HCl的作用是________。
②加热蒸发浓缩,当溶液体积减少到原来的![]() 时,调整水浴温度控制在_______时析出晶体,抽滤,洗涤,干燥。
时,调整水浴温度控制在_______时析出晶体,抽滤,洗涤,干燥。
③关于上述操作的说法不合理的是________。
A.抽滤时,需用玻璃纤维替代滤纸
B.洗涤晶体时应先关闭水龙头,再加入洗涤剂
C.抽滤完毕时,断开水泵和吸滤瓶之间的橡胶管,再关闭水龙头
D.为得到纯净的CuCl2·2H2O晶体宜采用低温干燥
(4)用“间接碘量法”测定CuCl2·2H2O样品的纯度,过程如下:取0.4000g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀,滴入几滴淀粉溶液作指示剂,用0.1000mol·L-1Na2S2O3 标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。(滴定反应为I2+2S2O32-=S4O62-+2I-)
①写出生成白色CuI沉淀的离子方程式________。
②该样品中CuCl2·2H2O的质量分数为________。