题目内容
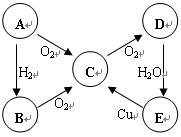
(8分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是
(2)X与W组成的化合物中存在 键(填“离子”“共价”)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为 。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式 。
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式
。
(1)X元素是
(2)X与W组成的化合物中存在 键(填“离子”“共价”)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为 。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式 。
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式
。
(1)H(1分) (2)共价(1分)
(3)3Cu + 2NO3— + 8H+=== 3Cu2+ + 2NO↑ + 4H2O(2分)
(4)① NH4+ + OH— H2O + NH3↑ (2分)
H2O + NH3↑ (2分)
② SO32— + Cl2 + H2O = SO42— + 2Cl— + 2H+ (2分)
(3)3Cu + 2NO3— + 8H+=== 3Cu2+ + 2NO↑ + 4H2O(2分)
(4)① NH4+ + OH—
 H2O + NH3↑ (2分)
H2O + NH3↑ (2分)② SO32— + Cl2 + H2O = SO42— + 2Cl— + 2H+ (2分)
根据元素的结构及其性质可知,短周期元素X是H。设Y的原子序数是a,则Z、W分别是a+1和a+10,因此由a+a+1+a+10+1=32,解得a=7,所以Y是N、Z是O、W是S。
(2)H和S都是非金属,形成的化学键是共价键。
(3)该强酸应该是硝酸,方程式为3Cu + 2NO3— + 8H+=== 3Cu2+ + 2NO↑ + 4H2O。
(4)①和强碱反应生成气体,因此气体是氨气,反应的方程式为NH4+ + OH— H2O + NH3↑。
H2O + NH3↑。
②氨气是2mol,且A还具有还原性,所以A是亚硫酸铵,所以与氯水反应的离子方程式为 SO32— + Cl2 + H2O = SO42— + 2Cl— + 2H+。
(2)H和S都是非金属,形成的化学键是共价键。
(3)该强酸应该是硝酸,方程式为3Cu + 2NO3— + 8H+=== 3Cu2+ + 2NO↑ + 4H2O。
(4)①和强碱反应生成气体,因此气体是氨气,反应的方程式为NH4+ + OH—
 H2O + NH3↑。
H2O + NH3↑。②氨气是2mol,且A还具有还原性,所以A是亚硫酸铵,所以与氯水反应的离子方程式为 SO32— + Cl2 + H2O = SO42— + 2Cl— + 2H+。

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
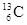 -NMR(核磁共振)可用于含碳化合物的结构分析,
-NMR(核磁共振)可用于含碳化合物的结构分析,

 )和甲胺(
)和甲胺(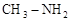 )都是含18个电子的分子。分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式(至少写两个):
)都是含18个电子的分子。分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式(至少写两个):