题目内容
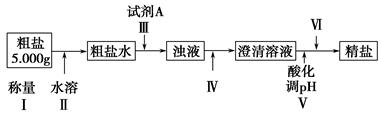
某研究性学习小组在用CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,因为加热温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。为探究X的成分,他们进行了如下实验(图中①②表示试剂的加入顺序)。
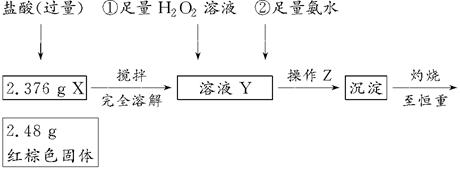
(1)操作Z是________。下列仪器中,在灼烧沉淀时必须用到的仪器名称是________;

(2)写出向溶液Y中滴加H2O2溶液时发生反应的离子方程式:________;
(3)通过以上数据,得出2.376 g黑色粉末X中各成分的物质的量为________。

(1)操作Z是________。下列仪器中,在灼烧沉淀时必须用到的仪器名称是________;

(2)写出向溶液Y中滴加H2O2溶液时发生反应的离子方程式:________;
(3)通过以上数据,得出2.376 g黑色粉末X中各成分的物质的量为________。
(1)过滤、洗涤(只答过滤不正确) 坩埚、泥三角
(2)2Fe2++2H++H2O2=2Fe3++2H2O
(3)n(Fe3O4)=0.01 mol,n(Fe)=0.001 mol
(2)2Fe2++2H++H2O2=2Fe3++2H2O
(3)n(Fe3O4)=0.01 mol,n(Fe)=0.001 mol
因为实验的目的是测定X的成分,这是一个定量实验,故过滤后的沉淀需要洗涤,灼烧固体时可以在坩埚中进行,坩埚应放在泥三角上。因2.48 g红棕色固体肯定是Fe2O3,其物质的量为0.0155 mol,所含铁元素的质量为1.736 g,因该数值小于2.376 g,故样品中含有Fe3O4。设样品中Fe3O4为x mol,Fe为y mol,则3x+y=0.031,232x+56y=2.376,解得x=0.01、y=0.001。

练习册系列答案
相关题目
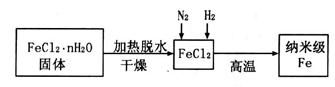
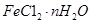 固体加热脱水通常要通入 。
固体加热脱水通常要通入 。 。甲同学用下图所示装置进行纳米级Fe粉与水蒸气的反应并验证固体产物。
。甲同学用下图所示装置进行纳米级Fe粉与水蒸气的反应并验证固体产物。