题目内容
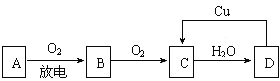
【题目】A、B、C、D四种物质之间有下图所示的转化关系.已知:A是空气中的主要成分,B、C、D均为化合物,且C为红棕色气体.
请回答下列问题:
(1)写出A和C的名称或化学式:A_________________,C________________;
(2)在上图D→C的过程中,D表现出强__________________(填“氧化性”或“还原性”);
(3)在D的稀溶液中滴入NaOH溶液,其反应的离子方程式是_________________________.
【答案】 N2 NO2 氧化性 H++OH﹣=H2O
【解析】C为红棕色气体,则C是NO2,NO2溶于水生成硝酸和NO。A是空气中的主要成分,且能和氧气反应,所以A是氮气,则B是NO,D能与Cu反应得到NO2,故D为HNO3,则
(1)由上述分析可知,A为N2,C为NO2;(2)图示D→C的过程中发生反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,反应中HNO3所含N元素化合价降低,硝酸表现出强氧化性;(3)在D的稀溶液中滴入NaOH溶液,其反应的离子方程式是:H++OH﹣=H2O。

 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案【题目】草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的制取、性质及应用,进行如下实验。
实验Ⅰ:草酸晶体的制备
实验室用硝酸氧化淀粉水解液法制备草酸,装罝如图所示:

①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体。
(1)上图实验装置中仪器甲的名称为________。冷凝水的进口是________(填“a”或“b” )。
(2)检验淀粉是否水解完全所需要的试剂为______________。
实验Ⅱ:探究草酸与酸性高锰酸钾溶液的反应
(3)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,可推测草酸可能具有________性。反应速率开始很慢,后来逐渐加快,可能的原因是_________。写出反应的离子方程式________________。
实验Ⅲ:草酸性质的应用
利用比H2C2O4与酸性KMnO4溶液反应探究“条件对化学反应速率的影响。”实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。设计方案如下:
编号 | H2C2O4溶液 | 酸性高锰酸钾溶液 | 温度/℃ | ||
浓度/molL-1 | 体积/mL | 浓度/molL-l | 体积/mL | ||
甲 | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
乙 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
丙 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(4)为了观察到紫色褪去,H2C2O4与KMnO4溶液初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥________。
(5)探究温度对化学反应速率影响的实验编号是___________,探究反应物浓度对化学反应速率影响的实验编号是__________。
实验Ⅳ:草酸晶体中结晶水测定
草酸晶体的化学式可表示为H2C2O4xH2O,为测定x的值,进行下列实验:
①称取6.3g某草酸晶体配成100. 0mL的水溶液。
②取25.00mL所配溶液置于锥形瓶中,加入适量稀H2SO4,用浓度为0.5ml/L的KMnO4溶液滴定,滴定终点时消耗KMnO4的体积为10.00mL。
(6)计算x= ________。