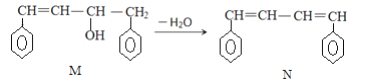
题目内容
【题目】一定温度下,在2L的体积不变的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。
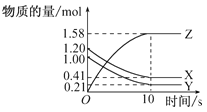
(1)写出该反应的化学方程式:________。
(2)从反应开始到10s,用Z表示的反应速率为________mol·L-1·s-1。
【答案】X(g)+Y(g)![]() 2Z(g) 0.079
2Z(g) 0.079
【解析】
据曲线图可判断出X、Y为反应物、Z为生成物。在同一反应中用不同的物质来表示反应速率时,其数值之比等于化学方程式中各物质的化学计量数之比。
(1)据曲线图可判断出X、Y为反应物、Z为生成物,且该反应为可逆反应。从反应开始到10 s末,Δn(X)=1.20 mol-0.41 mol=0.79 mol, Δn(Y)=1.00 mol -0.21 mol=0.79 mol,Δn(Z)=1.58 mol,所以化学方程式为X+Y![]() 2Z,故答案为:X+Y
2Z,故答案为:X+Y![]() 2Z;
2Z;
(2)反应开始到10s,用Z表示的反应速率为:υ(Z)= △c(Z)/△t =1.58mol÷2L÷10s =0.079mol/(Ls),故答案为:0.079。

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】废水中氨态氮以NH3H2O、NH3和NH4+的形式存在,废水脱氮已成为主要污染物减排和水体富营养化防治的研究热点。
Ⅰ.沉淀法
向废水中投入MgCl2和Na2HPO4,生成MgNH4PO46H2O沉淀,可将氨态氮含量降至10mg·L1以下。
(1)NH3的电子式:______。
(2)废水中的NH3H2O转化为MgNH4PO46H2O的离子方程式是______。

(3)16℃时,向废水中加入MgCl2和Na2HPO4,使镁、氮、磷物质的量之比为1︰1︰1,沉淀过程中的pH对剩余氨态氮浓度的影响如图。欲使剩余氨态氮浓度低于10mg·L1,pH的适宜范围是______,pH偏大或者偏小均不利于MgNH4PO46H2O的生成,原因是______。
Ⅱ.微波—氧化法
(4)仅对废水进行微波加热,pH对氨态氮脱出的影响如下表。
溶液pH | 6~7 | 8~9 | 10~11 | 11~12 |
剩余氨态氮浓度(mg·L1) | 156 | 100 | 40 | 14 |
表中数据表明:pH增大有利于废水中化学平衡______(用化学用语表示)的移动。
(5)微波协同CuO和H2O2除去氨态氮
①其他条件相同,取相同体积的同一废水样品,微波10min,剩余氨态氮浓度与一定浓度H2O2溶液添加量的关系如下图。据图推测CuO在氨态氮脱除中可能起催化作用,理由是______。

②微波协同CuO有利于H2O2除去氨态氮。该条件下,H2O2将NH3氧化为N2的化学方程式是______。