题目内容
用“>”、“<”或“=”填写下列空格:
(1)离子半径:Al3+
(2)酸性:H2SO4
(3)键的极性:H-F
(4)晶体的熔点:Si
(5)沸点:H2O
(6)原子的核外电子排布中,未成对电子数:24Cr
(7)元素的电子构型为ns2np3,B元素的电子构型为ns2np4,第一电离能:A
(1)离子半径:Al3+
<
<
Na+ (2)酸性:H2SO4
>
>
H2SeO4(3)键的极性:H-F
>
>
H-O (4)晶体的熔点:Si
<
<
SiC(5)沸点:H2O
>
>
H2S(6)原子的核外电子排布中,未成对电子数:24Cr
>
>
25Mn(7)元素的电子构型为ns2np3,B元素的电子构型为ns2np4,第一电离能:A
>
>
B.分析:(1)根据核外电子排布相同时,原子序数越小,半径越大;
(2)元素的非金属性越强,最高价氧化物对应水化物酸性越强;
(3)元素的非金属性越强,键的极性越强;
(4)原子晶体中,键长越短,熔沸点越高;
(5)根据水中含有分子间氢键,熔沸点增大;
(6)根据原子的核外电子排布式来判断;
(7)根据同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的.
(2)元素的非金属性越强,最高价氧化物对应水化物酸性越强;
(3)元素的非金属性越强,键的极性越强;
(4)原子晶体中,键长越短,熔沸点越高;
(5)根据水中含有分子间氢键,熔沸点增大;
(6)根据原子的核外电子排布式来判断;
(7)根据同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的.
解答:解:(1)核外电子排布相同时,原子序数越小,半径越大,所以离子半径:Al3+<Na+,故答案为:<;
(2)S的非金属性大于Se,所以最高价氧化物对应水化物酸性:H2SO4>H2SeO4,故答案为:>;
(3)F的非金属性大于O,所以键的极性:H-F>H-O,故答案为:>;
(4)Si、SiC都是原子晶体,Si中 Si-Si的键长大于SiC中Si-C的键长,所以晶体的熔点:Si<SiC,故答案为:<;
(5)水中含有分子间氢键,熔沸增大,所以H2O>H2S,故答案为:>;
(6)24Cr核外电子排布式:1s22s22p63s23p63d54s1,未成对电子数为6,25Mn核外电子排布式:1s22s22p63s23p63d54s2,未成对电子数为5,所以未成对电子数:24Cr>25Mn,故答案为:>;
(7)元素的电子构型为ns2np3,为第ⅤA族;B元素的电子构型为ns2np4,为第ⅥA族,所以第一电离能:A>B,故答案为:>.
(2)S的非金属性大于Se,所以最高价氧化物对应水化物酸性:H2SO4>H2SeO4,故答案为:>;
(3)F的非金属性大于O,所以键的极性:H-F>H-O,故答案为:>;
(4)Si、SiC都是原子晶体,Si中 Si-Si的键长大于SiC中Si-C的键长,所以晶体的熔点:Si<SiC,故答案为:<;
(5)水中含有分子间氢键,熔沸增大,所以H2O>H2S,故答案为:>;
(6)24Cr核外电子排布式:1s22s22p63s23p63d54s1,未成对电子数为6,25Mn核外电子排布式:1s22s22p63s23p63d54s2,未成对电子数为5,所以未成对电子数:24Cr>25Mn,故答案为:>;
(7)元素的电子构型为ns2np3,为第ⅤA族;B元素的电子构型为ns2np4,为第ⅥA族,所以第一电离能:A>B,故答案为:>.
点评:本题是道综合题,考查的知识点较多,掌握对应规律即可解答.

练习册系列答案
相关题目
 A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)位于小正方体的中心.
A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)位于小正方体的中心.

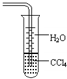 下列关于氨气的说法正确的是( )
下列关于氨气的说法正确的是( )
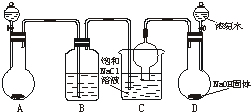 侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为:
侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为: