题目内容
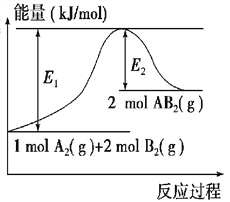
【题目】某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( ) 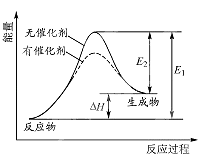
A.该反应为放热反应
B.催化剂能改变该反应的焓变
C.催化剂能降低该反应的活化能
D.逆反应的活化能大于正反应的活化能
【答案】C
【解析】解:A、图象中反应物能量低于生成物能量,故反应是吸热反应,故A错误;B、催化剂不能改变该反应的焓变,只能改变反应速率,故B错误;
C、催化剂改变化学反应速率是降低了反应的活化能,故C正确;
D、图象分析逆反应的活化能E2小于正反应的活化能E1 , 故D错误;
故选C.
A、依据图象中反应物和生成物能量的大小比较判断;
B、催化剂改变速率不改变平衡;
C、催化剂改变化学反应速率是降低了反应的活化能;
D、图象中分析判断;

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】相同温度下,体积均为0.25 L 的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)2NH3(g)△H=﹣92.6 kJ/mol.实验测得起始、平衡时数据如下表( )
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15kJ |
② | 0.8 | 2.4 | 0.4 | 放出热量:Q |
A.容器①、②中反应的平衡常数相等,平衡时氮气的转化率相等
B.平衡时,两个容器中NH3 的体积分数均为1/8
C.容器②中达平衡时放出的热量Q=4.63 kJ
D.若容器①改为恒压体系,充入0.25 L He,则平衡时放出的热量大于23.15 kJ
【题目】下列各物质含少量杂质,除去这些杂质应选用的试剂或操作方法正确的是( )
序号 | 物质 | 杂质 | 除杂应选用的试剂或操作方法 |
A | KNO3溶液 | KOH | 加入FeCl3溶液,并过滤 |
B | FeSO4溶液 | CuSO4 | 加入过量铁粉,并过滤 |
C | H2 | CO2 | 通过盛NaOH溶液的洗气瓶 |
D | H2 | O2 | 通过灼热Cu粉 |
A. AB. BC. CD. D