题目内容
(1)有一学生在实验室测某溶液pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。①该学生的操作是__________(填“正确的”或“错误的”),其理由是___________________。
②如不正确请说明理由,同时请分析是否一定有误差?答_____________________。
③若用此法分别测定[H+]相等的盐酸和醋酸溶液的pH,误差较大的是_________________,原因是_____________________________________________。
(2)若以铁棒、碳棒、导线和氯化铁溶液为用品设计原电池。
负极材料为_______________,电极反应式为_______________;
正极材料为_______________,电极反应式为_______________;
电池总反应式为______________________________________________________。
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。
①反应的热化学方程式为__________________。
②又已知H2O(l)![]() H2O(g) ΔH=+44 kJ·mol-1,则
H2O(g) ΔH=+44 kJ·mol-1,则
③此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大的优点是_________。
解析:(2)铁、碳、FeCl3组成原电池,Fe是活泼金属作负极,碳不活泼作正极,FeCl3溶液作电解质溶液。
(3)0.4 mol液体肼与足量双氧水反应放出256.652 kJ热量,则1 mol肼放出热量为![]() × 256.652 kJ=641.63 kJ;
× 256.652 kJ=641.63 kJ;![]() × 641.63 kJ·mol-1+44 kJ·mol-1×2 mol=408.8 kJ。
× 641.63 kJ·mol-1+44 kJ·mol-1×2 mol=408.8 kJ。
答案:(1)①错误,该学生测得的是稀释后的pH。
②若溶液不显中性,则H+或OH-被稀释,测得的不为原溶液对应的pH;不一定有误差,当溶液为中性时,则没有误差。
③盐酸,醋酸在冲稀过程中能电离出H+,使得醋酸中H+大于盐酸中H+,测量盐酸pH较大,误差较大。
(2)铁棒 Fe-2e-![]() Fe2+ 碳棒 2Fe3++2e-
Fe2+ 碳棒 2Fe3++2e-![]() 2Fe2+ Fe+2Fe3+
2Fe2+ Fe+2Fe3+![]() 3Fe2+
3Fe2+
(3)①N2H4(l)+2H2O2(l)![]() N2(g)+4H2O(g);ΔH=-641.63 kJ·mol-1
N2(g)+4H2O(g);ΔH=-641.63 kJ·mol-1
②408.8
③对环境无污染

Ⅰ、(8分)有一学生在实验室测某溶液的pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒醮取试样进行检测。
(1)该学生的操作是 (填“正确的”或“错误的”)。
(2)如不正确,是否一定有误差?答: (填“是”或“否”)
(3)若按此法分别测定C(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 ,原因是 。
Ⅱ、(10分)
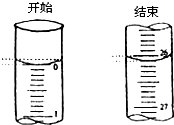
(1)如图表示50mL滴定管中液面的位置,其读数是 mL
(2)乙二酸俗名草酸,某化学学习小组的同学欲探究测定
|
①、下列仪器在进行滴定时,绝不可以事先润洗的是 (填编号)。
甲.酸式滴定管 乙.碱式滴定管 丙.25mL量筒 丁.锥形瓶
②、滴定时,将KMnO4标准液装在 滴定管中。
③、 本实验滴定达到终点的标志可以是
。
④、 若滴定终点时俯视滴定管刻度,则由此测得的x值会 (填“偏大”、“偏小”或“不变”)。
 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白: