题目内容
【题目】I.如图是一套制取并验证氯气部分化学性质的实验装置(装置A制取氯气)。
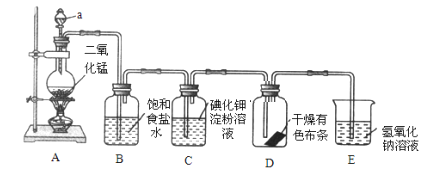
回答下列问题:
(1)当Cl2持续通过时,装置D中干燥的有色布条能否褪色?为什么?__,__。
(2)若要证明干燥的Cl2无漂白性,可在装置D前添加一个装有__的洗气瓶。
(3)装置E的作用是___,该反应的离子方程式为__。
II.欲用98%的浓硫酸(密度为1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500mL。
(4)所需浓硫酸的体积为___mL。
(5)选用的主要仪器有:烧杯、量筒、胶头滴管、玻璃棒和___。
(6)操作正确的顺序为___(填序号)。
A.用量筒量取浓硫酸 B.反复颠倒摇匀 C.用胶头滴管加水至刻度 D.将配制好的溶液转入试剂瓶中贴上标签 E.稀释浓硫酸 F.将溶液转入容量瓶
(7)在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度___0.5mol·L-1(填“大于”“小于”或“等于”)。
(8)该同学在定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响__(填“偏高”、“偏低”或“无影响”)。
【答案】能褪色 因为Cl2与带出的H2O(g)反应生成HClO,使有色布条褪色 浓H2SO4 除去多余的Cl2 Cl2+2OH=Cl+ClO+H2O 13.6 500mL容量瓶 AEFCBD 小于 偏低
【解析】
I.(1)氯气遇到干燥的有色布条不能褪色,起漂白作用的是次氯酸;
(2)若要证明Cl2无漂白性,需在CD之间加一个装有浓硫酸的洗气瓶;
(3)氯气是污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收;
II.(4)依据c=![]() 计算浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸体积;
计算浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸体积;
(5)依据配制一定物质的量浓度溶液一般步骤选择需要的仪器;
(6)根据实验操作的步骤:计算→量取→稀释、冷却→移液→洗涤→定容→摇匀→装瓶贴签排序;
(7)在实验中其他操作均正确,若定容时仰视刻度线,溶液的体积偏大;
(8)加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,溶液被稀释。
I. (1)湿润的氯气遇到干燥的有色布条能褪色,因为Cl2与带出的H2O(g)反应生成HClO,起漂白作用的是次氯酸,则能使干燥的有色布条褪色;
(2)若要证明Cl2无漂白性,需在CD之间加一个装有浓硫酸的洗气瓶;
(3)氯气是污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收,反应的离子方程式为Cl2+2OH-=Cl-++ClO-+H2O;
II.(4)98%的浓硫酸(密度=1.84gcm-3)物质的量浓度为:![]() =18.4mol/L;设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=0.5molL-1×500mL,解得V=13.6mL;
=18.4mol/L;设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=0.5molL-1×500mL,解得V=13.6mL;
(5)配制一定物质的量浓度溶液一般步骤计算→量取→稀释、冷却→移液→洗涤→定容→摇匀→装瓶贴签用到的仪器:量筒、烧杯、玻璃棒、胶头滴管、500mL容量瓶,所以还缺少的仪器为:500mL容量瓶;
(6)配制一定物质的量浓度溶液一般步骤计算→量取→稀释、冷却→移液→洗涤→定容→摇匀→装瓶贴签,所以正确的操作顺序为:A→E→F→C→B→D;
(7)在实验中其他操作均正确,若定容时仰视刻度线,溶液的体积偏大,溶液的浓度偏小,即小于0.5mol·L-1;
(8)加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,加水稀释了溶液,对所配溶液浓度的影响是浓度偏低。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】甲醇是重要的化工原料。在催化剂的作用下,利用合成气(主要成分为CO、CO2和H2)合成甲醇的主要化学反应如下:
Ⅰ.CO+2H2CH3OH
Ⅱ.CO2+3H2CH3OH+H2O
Ⅲ.CO2+H2CO+H2O
请回答下列问题:
(1)已知三种物质的标准燃烧热如下表:
物质 | CO(g) | H2(g) | CH3OH(l) |
燃烧热(kJ·mol1) | 283.0 | 285.8 | 726.51 |
①书写25℃、101kPa条件时CO燃烧热的热化学方程式______________________。
②计算25℃、101kPa条件时反应Ⅰ的ΔH=_____kJ·mol1 。
(2)甲醇燃料电池(Direct Methanol Fuel Cell)属于质子交换膜燃料电池,其工作原理如图所示:
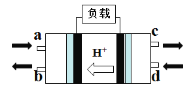
①c处产生的气体是________。
②负极的电极反应式是____________。
(3)下图是甲醇燃料电池工作示意图,其中A,B,D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A,B两极上产生的气体体积相同。
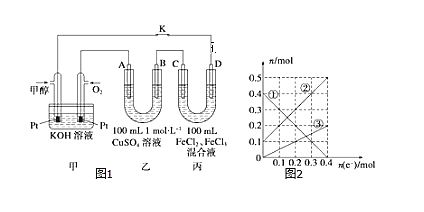
①乙中B极的电极反应式_______。
②乙中A极析出的气体在标况下的体积________。
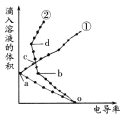
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则②线表示的是____的变化,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要____mL 5mol/LNaOH溶液。
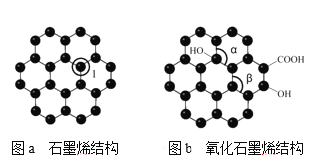
【题目】含硼、氮、磷、铜、锌的化合物有许多重要用途。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为____;基态Cu+的核外电子排布式为___。
(2)化合物(CH3)3N能溶于水的原因是______。
(3)亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式为____。
(4)Zn2+可与CN-、二苯硫腙(![]() )等形成稳定配合物。
)等形成稳定配合物。
①CN- 的结构式为_____。
②每个二苯硫腙分子中,采取sp2杂化的原子有__个。
(5)卤化锌的熔点如表所示:
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
ZnF2的熔点远高于其它三种卤化锌,其原因为_____。
(6)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图1所示:
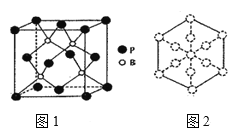
①磷化硼晶胞沿着体对角线方向的投影如图2,请在答题卡上将表示B原子的圆圈涂黑____。
②已知磷化硼晶体的密度为ρ g/cm3,阿伏加德罗常数为NA,则B—P键长为___pm(列出计算式即可)。