题目内容
已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g),△H=+49.0kJ?mol-1
②CH3OH(g)+
O2(g)=CO2(g)+2H2(g),△H=-192.9kJ?mol-1
下列说法正确的是( )
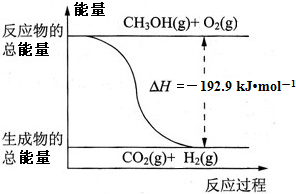
②CH3OH(g)+
| 1 |
| 2 |
下列说法正确的是( )
| A.CH3OH转变成H2的过程一定要吸收能量 | ||
| B.①反应中,反应物的总能量高于生成物总能量 | ||
C.根据②推知反应:CH3OH(l)+
| ||
| D.反应②中的能量变化如图所示 |

A、反应①是吸热反应,反应②是放热反应,CH3OH转变成H2的过程不一定要吸收能量,故A错误;
B、①CH3OH(g)+H2O(g)=CO2(g)+3H2(g),△H=+49.0kJ?mol-1,反应是吸热反应,生成物能量高于反应物,故B错误;
C、CH3OH(l)变化为CH3OH(g)需要吸热,CH3OH(l)+
O2(g)=CO2(g)+2H2(g)的△H>-192.9 kJ?mol-1 ,故C正确;
D、物质的量不同焓变不同,图象不能反映反应过程,故D错误;
故选C.
B、①CH3OH(g)+H2O(g)=CO2(g)+3H2(g),△H=+49.0kJ?mol-1,反应是吸热反应,生成物能量高于反应物,故B错误;
C、CH3OH(l)变化为CH3OH(g)需要吸热,CH3OH(l)+
| 1 |
| 2 |
D、物质的量不同焓变不同,图象不能反映反应过程,故D错误;
故选C.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目