题目内容
下列分子或离子在指定的分散系中能大量共存的一组是
| A.纯碱溶液:NH4+、K+、NO3-、NH3·H2O |
| B.空气:C2H2、CO2、SO2、NO |
| C.氢氧化铁胶体:H+、K+、S2-、Br- |
| D.高锰酸钾溶液:H+、Na+、SO42-、H2O2 |
A
解析试题分析:A纯碱溶液呈碱性,在碱性环境选项中的离子可共存,正确。B在空气中NO发生反应:2NO+O2=2NO2错误。C氢氧化铁胶体呈碱性,这时,H+与OH-、S2-会反应,错误。D反应方程式为2KMnO4+5H2O2+3H2SO4==MnSO4+K2SO4+8H2O+5O2↑,错误。
考点:考查离子共存等知识。

练习册系列答案
相关题目
水溶液X中只可能溶有K+、Mg2+、Al3+、[Al(OH)4]-、SiO2-3、SO32-、CO 32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验:
下列判断错误的是
| A.气体甲可能是混合物 |
| B.沉淀甲是硅酸和硅酸镁的混合物 |
| C.白色沉淀乙的主要成分是氢氧化铝 |
| D.K+、[Al(OH)4]-和SiO 32-一定存在于溶液X中 |
在碱性溶液中能大量共存且溶液为无色透明的一组离子是
A. 、 、 、 、 、 、 | B.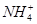 、 、 、 、 、 、 |
C. 、 、 、 、 、 、 | D. 、 、 、 、 、 、 |
能正确表示下列反应的离子方程式是
A.向0.1mol/L的Na2S溶液中加入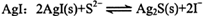 |
B.碳酸钠溶液显碱性的原因: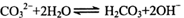 |
C.二氧化硫通入氯化铁溶液: |
D.用醋酸清洗盛放石灰水试剂瓶内壁出现的白色固体: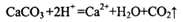 |
下列表示对应化学反应的离子方程式正确的是( )
| A.漂白粉露置在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| B.向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| C.向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+ |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2 Fe(OH)3= 2FeO42-+ 3Cl-+ H2O+ 4H+ |
常温下,下列各组离子或分子在指定溶液中能大量共存的是( )
| A.氨水中:NH4+、Fe2+、SO42-、HSO3- |
| B.pH=l的溶液中:、Mg2+、Fe3+、Cl-、NO3- |
| C.通入足量CO2的溶液中:Ca2+、Na+、SiO32-、CO32- |
| D.由水电离出的c(OH-)=1×10—12mol·L—1的溶液中:NH4+、HCO3-、Na+、Cl- |
在下述条件下,一定能大量共存的离子组是
| A.无色透明的水溶液中:K+、Ba2+、I-、MnO4- |
| B.含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+ |
| C.能与Al反应产生H2的溶液中:HCO3-、Na+、Al3+、Br- |
| D.常温下pH=1的溶液中:Mg2+、Cl-、SO42-、Fe3+ |
下列各组离子在溶液中可以大量共存的是
| A.Ag+、NO3-、Cl-、Na+ | B.Na+、Ba2+、Mg2+、NO3- |
| C.OH-、K+、HCO3-、Ba2+ | D.H+、CO32-、K+、Ca2+ |
某混合溶液,含以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,分别取三份各100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
| A.100mL溶液中含0.01mol CO32- | B.Cl-一定存在 |
| C.K+一定存在 | D.Ba2+一定不存在,Mg2+可能存在 |