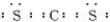题目内容
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9.单质Y和W都可与浓的NaOH溶液反应.下列说法不正确的是( )
分析:X原子的最外层电子数与次外层电子数相等,短周期中只有Be和Ar,此处显然X是Be;X与W最外层电子数之和为9,则W的最外层电子数为7,应为Cl元素,单质Y可与浓的NaOH溶液反应,可为Al或Si,则Z可为S或P,由题中其中只有两种为金属可知Y为Al,Z为S,根据元素周期律的递变规律和对应物质的性质解答该题.
解答:解:原子的最外层电子数与次外层电子数相等,短周期中只有Be和Ar,此处显然X是Be;X与W最外层电子数之和为9,则W的最外层电子数为7,应为Cl元素,单质Y可与浓的NaOH溶液反应,可为Al或Si,则Z可为S或P,由题中其中只有两种为金属可知Y为Al,Z为S,
A.由以上分子可知Y、Z、W为同周期元素,且原子序数依次增大,原子半径应依次减小,故A正确;
B.W为Cl,在四种元素中非金属性最强,故B正确;
C.Y可能为Al,对应的最高价氧化物对应的水化物为弱碱或弱酸,故C错误;
D.XW2为BeCl2,Be中原子最外层电子电子数为2,故D错误.
故选CD.
A.由以上分子可知Y、Z、W为同周期元素,且原子序数依次增大,原子半径应依次减小,故A正确;
B.W为Cl,在四种元素中非金属性最强,故B正确;
C.Y可能为Al,对应的最高价氧化物对应的水化物为弱碱或弱酸,故C错误;
D.XW2为BeCl2,Be中原子最外层电子电子数为2,故D错误.
故选CD.
点评:本题考查原子结构与元素的性质,侧重于元素周期律的考查,注意根据原子结构特点判断元素的种类,为解答该题的关键,易错点为D,注意原子核外电子排布规律.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目