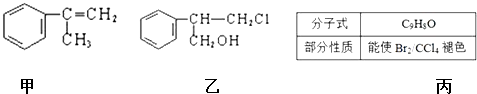题目内容
【题目】煤是重要的化工原料,煤的脱硫可减少环境的污染,利用煤矸石中的硫铁矿(主要成分为FeS2)和烟道脱硫得到的硫酸盐生产硫酸的工艺流程如图所示. 
回答下列问题:
(1)硫铁矿和硫酸盐燃烧的装置M的名称为 .
(2)炉气净化过程包括除尘(防止堵塞管道)、洗涤(除去有害物质,防止在转化器中使催化剂中毒)和干燥,干燥的目的是 .
(3)转化器中的催化剂是V2O3 , 而反应条件选择400~500℃和常压的原因是 . 已知每生成1molSO2(g),释放148.5kJ热量,写出该反应的热化学方程式: , 该反应过程中通入稍过量O2的目的是
(4)实验生产中常采用两次转化,其目的是 , 流程中可循环利用的物质是 .
(5)该方法合成硫酸的优点是;按目前技术水平生产硫酸的流程中,反应热的利用约为 ![]() ,试提出利用富余反应热的方法: .
,试提出利用富余反应热的方法: .
【答案】
(1)沸腾炉
(2)防止硫的氧化物与水反应生成酸雨腐蚀设备
(3)400~500℃时催化剂的活性最大,常压下二氧化硫的转化率已经很高,再增加压强,会提高设备成本;2SO2(g)+O2(g)?2SO3(g)△H=﹣297kJ/mol;提高二氧化硫的转化率
(4)提高原料利用率;SO2和O2
(5)变废为宝,减少环境污染;利用余热发电
【解析】解:(1)硫铁矿和硫酸盐在沸腾炉中燃烧,所以答案是:沸腾炉;(2)硫的氧化物与水反应生成酸性物质,腐蚀设备,所以答案是:防止硫的氧化物与水反应生成酸雨腐蚀设备;(3)400~500℃时催化剂的活性最大,常压下二氧化硫的转化率已经很高,再增加压强,会提高设备成本;每生成1molSO2(g),释放148.5kJ热量,每生成2molSO2(g),释放297kJ热量,2SO2(g)+O2(g)2SO3(g)△H=﹣297kJ/mol;增大一种反应物的量可提高另一种反应物的转化率,提高二氧化硫的转化率,所以答案是:400~500℃时催化剂的活性最大,常压下二氧化硫的转化率已经很高,再增加压强,会提高设备成本;2SO2(g)+O2(g)2SO3(g)△H=﹣297kJ/mol;提高二氧化硫的转化率;(4)两次转化可提高原料利用率,SO2和O2可循环利用,所以答案是:提高原料利用率;SO2和O2;(5)废气中的二氧化硫变废为宝,减少环境污染,可利用余热发电或取暖,所以答案是:变废为宝,减少环境污染;利用余热发电.