题目内容
【题目】在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患。检测某工厂废液中含有大量Mg2+、Al3+、Cu2+、Ag+。试分析回答下列问题:
(1)该废液中可能大量存在的一种阴离子是 (填序号);
A.SO![]() B.NO
B.NO![]() C.Cl
C.Cl![]() D.CO
D.CO![]()
(2)为检测废液中铝元素的含量需将其从废水样品中分离出来,所用的试剂是 ;其中镁元素发生变化的离子方程式是 ;
(3)为了回收废液中的金属银,某同学设计了如下方案:
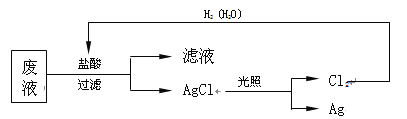
若该方案获得Ag 108 g,为保证不污染环境和Cl2的循环利用,理论上应提供标准状况下的H2的体积是 L。
【答案】
(1)B;
(2)NaOH; Mg2+ +OH- = Mg( OH)2;
(3)11.2
【解析】
试题分析:(1)因硫酸银不溶液水,氯化银不溶于水,金属离子与碳酸根离子生成不溶于水的碳酸盐,所有的硝酸盐都溶于水,即硝酸根离子与金属离子均不反应,故答案为:B;
(2)只有氢氧化铝与碱反应,利用碱将金属阳离子分离,则试剂选NaOH溶液,其中镁元素发生变化的离子方程式为Mg2+ +OH- = Mg( OH)2,故答案为:NaOH溶液;Mg2+ +OH- = Mg( OH)2;
(3)n(Ag)=![]() =1mol,由2Ag~Cl2~H2可知,理论上应提供标准状况下H2的体积为0.5mol×22.4L/mol=11.2L,故答案为:11.2L。
=1mol,由2Ag~Cl2~H2可知,理论上应提供标准状况下H2的体积为0.5mol×22.4L/mol=11.2L,故答案为:11.2L。

练习册系列答案
相关题目