题目内容
A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是( )
A.A、B、C、D、E B.E、C、D、B、A
C.B、A、D、C、E D.C、D、A 、B、E
C
解析试题分析:同周期元素从左到右随着原子序数的增大,原子半径逐渐减小,元素的金属性逐渐减弱,非金属性逐渐增强。元素的金属性越强,其最高价氧化物对应的水化物的碱性就越强。元素的非金属性越强,其对应的氢化物的稳定性就越强。A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,则一种序数A<B;C和D都能形成气态氢化物则原子序数C、D要比A、B的大。由于C和D的气态氢化物的稳定性C>D,则原子序数D<C。E是这五种元素中原子半径最小的元素,则E的原子序数最大。因此这五种元素的原子序数由小到大的顺序是B、A、D、C、E。正确选项为C。
考点:考查同一周期的元素的金属性、非金属性及原子半径的变化规律的知识。

 阅读快车系列答案
阅读快车系列答案已知16S、34Se位于同一主族,下列关系正确的是
| A.热稳定性:H2Se> H2S> HCl | B.原子半径:Se>P>Si |
| C.酸性:H3PO4>H2SO4>H2SeO4 | D.还原性:Se2->Br->Cl- |
在短周期元素中,原子最外电子层只有1个或2个电子的元素是( )
| A.金属元素 | B.稀有气体元素 | C.非金属元素 | D.无法确定为哪一类元素 |
短周期主族元素X、Y、Z、W的原子序数依次增大,原子半径:r(W)>r(Y)>r(Z)>r(X)。X与W同主族,Z原子最外层电子数是其内层电子总数的3倍,Z原子的核电荷数等于X、Y原子核电荷数之和。下列说法正确的是
| A.元素Z、W的简单离子的电子层结构不同 |
| B.元素Y的简单气态氢化物的热稳定性比Z的强 |
| C.仅由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性 |
| D.化合物X2Z2与W2Z2所含化学键类型完全相同 |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C.由X元素形成的单质不一定是原子晶体 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
放射性同位素电池采用的放射性同位素主要有90 38Sr等。下列关于90 38Sr的说法正确的是
| A.质子数为90 | B.中子数为38 | C.电子数为52 | D.质量数为90 |
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。已知Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )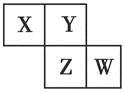
| A.原子半径:W>Z>Y>X |
| B.最高价氧化物对应水化物的酸性:Z>W>X |
| C.氢化物的稳定性:X>Y>Z |
| D.四种元素的单质中,Z单质的熔、沸点最高 |