题目内容
【题目】氟及氟产品在工农业生产中应用非常广泛,回答下列问题:
(1)基态氟原子核外电子的运动状态有__种,这些电子的电子云形状有__种;氟原子的外围电子排布式为______.
(2)NaHF2(氟化氢钠)电解可制氟气,NaHF2中所含作用力的类型有_____;与HF2-互为等电子体的分子有___(举一例).
(3)N2F2(二氟氮烯)分子中,氮原子的杂化轨道类型为____.
(4)三氟化硼乙醚(如图1)的熔点为-58℃,沸点为126~129℃,它属于__晶体.
(5)氟化钙的晶胞结构如图2所示,晶胞参数α=0.555nm.
①Ca2+、F-的配位数分别为__和__.
②列式表示氟化钙晶体的密度:_________gcm-3(不必计算出结果).
【答案】 9 2 2s22p5 离子键、共价键、氢键 CO2(或N2O) sp2 分子 8 4 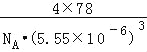
【解析】
(1)基态氟原子核外有9个电子,则其核外电子的运动状态有9种;氟原子核外含有2s轨道和p轨道两种轨道,则氟原子电子的电子云形状有2种;氟原子的外围含有7个电子,其外围电子排布式为:2s22p5。
(2)NaHF2为离子化合物,存在离子键,H-F键为共价键,F的电负性较强,还存在氢键,所以NaHF2中所含作用力的类型有离子键、共价键、氢键;等电子体是指具有相同价电子数目和原子数目的分子或离子,根据等电子体的定义,与HF2-互为等电子体的分子有CO2(或N2O)。
(3)N2F2(二氟氮烯)分子中,氮原子形成了3个σ键和1个π键,则其杂化轨道类型为sp2。
(4)三氟化硼乙醚的熔点为-58℃,沸点为126~129℃,其熔沸点降低,应该属于分子晶体。
(5)①在CaF2晶胞中每个Ca2+连接4个氟离子,但在下面一个晶胞中又连接4个氟离子,所以其配位数为8;在CaF2晶胞中每个F-连接4个钙离子,所以其配位数为4。
②该晶胞中含有钙离子个数=8×1/8+6×1/2=4,氟离子在该晶胞的内部,所以氟离子个数是8,该晶胞中含有4个CaF2,该晶胞的体积为:V=(5.55×10-6)3cm3,该晶胞的密度为:ρ=m÷V=![]() gcm-3。
gcm-3。


