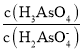��Ŀ����
����Ŀ����֪��![]() ʱ��
ʱ��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��
![]() ��Һ��NaHA��Һ��Ӧ����Ҫ���ӷ���ʽΪ________________________________
��Һ��NaHA��Һ��Ӧ����Ҫ���ӷ���ʽΪ________________________________![]() ������
������![]() ��
��![]() ����������ԭ��Ӧ
����������ԭ��Ӧ![]() ��
��
![]() ��Һ������Ũ���ɴ�С��˳��Ϊ ____________________________��
��Һ������Ũ���ɴ�С��˳��Ϊ ____________________________��
![]() ʱ����
ʱ����![]() ��HCOOH��Һ��
��HCOOH��Һ��![]() ��
��![]() ��Һ�ֱ���
��Һ�ֱ���![]() ��
��![]() ��Һ��ϣ�ʵ���ò������������
��Һ��ϣ�ʵ���ò������������![]() ��ʱ��
��ʱ��![]() �仯��ʾ��ͼ��ͼ��ʾ��
�仯��ʾ��ͼ��ͼ��ʾ��
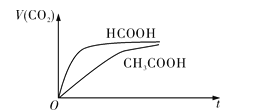
![]() �ĵ���ƽ�ⳣ������ʽ
�ĵ���ƽ�ⳣ������ʽ![]() __________________________��
__________________________��
![]() ��Ӧ��ʼ�Σ�������Һ����
��Ӧ��ʼ�Σ�������Һ����![]() ��������ʴ������Բ����ԭ����__________________________________________________________________________________����Ӧ��������������Һ�У�
��������ʴ������Բ����ԭ����__________________________________________________________________________________����Ӧ��������������Һ�У�![]() ____________
____________![]() ����
����![]() ����
����![]() ������
������![]() ��
��![]() ��
��
![]() ʱ��ij��Һ�к���
ʱ��ij��Һ�к���![]() ��
��![]() ����KOH�����Ե�����Һ
����KOH�����Ե�����Һ![]() ������Һ����ı仯������
������Һ����ı仯������ ![]() �Ļӷ��ͷֽ�
�Ļӷ��ͷֽ�![]() ����pHΪ7ʱ���ܷ���
����pHΪ7ʱ���ܷ���![]() �������ɣ�________
�������ɣ�________![]() ����������������
����������������![]() ��
��
���𰸡�![]()
![]()
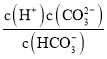
![]() �����Ա�
�����Ա�![]() ǿ����Ũ�ȵ�HCOOH��Һ�е�
ǿ����Ũ�ȵ�HCOOH��Һ�е�![]() �ϴ�����Һ��
�ϴ�����Һ��![]() ��Һ�ķ�Ӧ���ʽϿ�
��Һ�ķ�Ӧ���ʽϿ� ![]() ��
��
��������
![]() ��
��![]() ��
��![]() ����
����![]() ������ƽ�ⳣ��Խ������Խǿ��ǿ����������
������ƽ�ⳣ��Խ������Խǿ��ǿ����������
��2��![]() ��Һ�д������������ˮ��������������ˮ�⣬�ҵ�һ��ˮ����ڵڶ���ˮ�⣬��Һ�ʼ��ԣ�
��Һ�д������������ˮ��������������ˮ�⣬�ҵ�һ��ˮ����ڵڶ���ˮ�⣬��Һ�ʼ��ԣ�
��3��![]() ���ݵ��뷽��ʽ��֪K=
���ݵ��뷽��ʽ��֪K=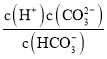 ��
��
![]() ��Ũ��Խ��Ӧ����Խ�죬������Һ����Խ������Ӧ���ɵ���Ӧ������Խ��ˮ�⣻
��Ũ��Խ��Ӧ����Խ�죬������Һ����Խ������Ӧ���ɵ���Ӧ������Խ��ˮ�⣻
��4������pHֵ��![]() ��������������Ũ�ȣ���
��������������Ũ�ȣ���![]() ���������ɳ���������pHֵ��
���������ɳ���������pHֵ��![]() ��������������Ũ�ȡ�
��������������Ũ�ȡ�
![]() ��
��![]() ��
��![]() ����
����![]() ������������Ƶ�
������������Ƶ�![]() ��ͬʱ������������������ӷ���ʽΪ��
��ͬʱ������������������ӷ���ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
![]() ��Һ�д������������ˮ��������������ˮ�⣬�ҵ�һ��ˮ����ڵڶ���ˮ�⣬��Һ�ʼ��ԣ�������Ũ��Ϊ��
��Һ�д������������ˮ��������������ˮ�⣬�ҵ�һ��ˮ����ڵڶ���ˮ�⣬��Һ�ʼ��ԣ�������Ũ��Ϊ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
![]() ̼��������ӵ��뷽��ʽΪ��
̼��������ӵ��뷽��ʽΪ��![]() �������ƽ�ⳣ������ʽΪK=
�������ƽ�ⳣ������ʽΪK=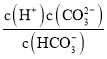 ���ʴ�Ϊ��
���ʴ�Ϊ��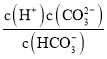 ��
��
![]() ����������HCOOH�ģ�������ͬŨ�ȵ������HCOOH��Һ��
����������HCOOH�ģ�������ͬŨ�ȵ������HCOOH��Һ��![]() ��Ũ�ȴ���
��Ũ�ȴ���![]() ��Һ��
��Һ��![]() ��Ũ�ȣ�Ũ��Խ��Ӧ����Խ�죬������Һ����Խ������Ӧ���ɵ���Ӧ������Խ��ˮ�⣬���Է�Ӧ������
��Ũ�ȣ�Ũ��Խ��Ӧ����Խ�죬������Һ����Խ������Ӧ���ɵ���Ӧ������Խ��ˮ�⣬���Է�Ӧ������![]() ���ʴ�Ϊ��HCOOH�����Ա�
���ʴ�Ϊ��HCOOH�����Ա�![]() ǿ����Ũ�ȵ�HCOOH��Һ�е�
ǿ����Ũ�ȵ�HCOOH��Һ�е�![]() �ϴ�����Һ��
�ϴ�����Һ��![]() ��Һ�ķ�Ӧ���ʽϿ죻
��Һ�ķ�Ӧ���ʽϿ죻![]() ��
��
![]() ��pHΪ7ʱ��
��pHΪ7ʱ��![]() ��SԪ�صĴ�����ʽΪ
��SԪ�صĴ�����ʽΪ![]() ��
��![]() ��
��![]() ����
����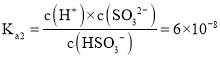 �������ɵ�
�������ɵ�![]() ��
��![]() ���������ɳ������ʴ�Ϊ���ܡ�
���������ɳ������ʴ�Ϊ���ܡ�

����Ŀ����a��b��c��d�ĸ������缫���йص�ʵ��װ�ü�����ʵ���������£�
ʵ��װ�� |
|
|
����ʵ������ | a��������Сb���������� | b�������ݲ���c���ޱ仯 |
ʵ��װ�� |
|
|
����ʵ������ | d���ܽ�c�������ݲ��� | ������a������d�� |
�ɴ��ж������ֽ����Ļ��˳����(����)
A. a>b>c>dB. d>a>b>cC. b>c>d>aD. a>b>d>c
����Ŀ��������Ƶ�ʵ�鷽���ܴﵽ��Ӧʵ��Ŀ������������
ѡ�� | ʵ��Ŀ�� | ʵ�鷽�� |
A | �����ʷ����˱��� | ������Һ�м���CuCl2��(NH4)2SO4������Һ |
B | ֤����Ӧ���ʻ��淴Ӧ��Ũ�ȵ�������ӿ� | ��3mLϡ������������п��Ӧ�������������ʽ�����Ȼ�����1mL 1mol��L��1CuSO4��Һ��Ѹ�ٲ����϶����� |
C | �Ƚ�Ksp(BaCO3)��Ksp(BaSO4) | �����£���Na2CO3��Һ�м�����BaSO4��ĩ�����ˣ���ϴ���ij����м�ϡ���ᣬ�����ݲ��� |
D | ͨ���۲�Һ����жϸ�װ�õ������� |
|
A. A B. B C. C D. D