题目内容
【题目】Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的分子量为248)步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。
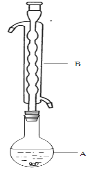
④滤液在经过 、 后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________________。其作用是___________。加入的硫粉用乙醇润湿的目的是 。
(2)步骤④应采取的操作是 、 。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是 。如果滤液中该杂质的含量不很低,其检测的方法是: 。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用 (填“酸式”或“碱式”)滴定管来滴定(2S2O32- + I2 = S4O62- + 2I-),滴定结果如下:
滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
第一次 | 0.30 | 31.12 |
第二次 | 0.36 | 31.56 |
第三次 | 1.10 | 31.88 |
则所得产品的纯度为 ,你认为影响纯度的主要原因是(不考虑操作引起误差) 。
【答案】
(1)冷凝管或冷凝器;冷凝回流;增加反应物的接触面积,加快反应速率;
(2)蒸发浓缩、冷却结晶
(3)Na2SO4;取出少许滤液置于试管,加稀盐酸至溶液呈酸性后,过滤得出S,再往滤液中加BaCl2溶液, 如有白色沉淀即可证明含有Na2SO4;
(4)酸式;103.2%;其中含有的Na2SO3也会和I2发生反应,从而影响纯度
【解析】
试题分析:
(1)根据仪器的结构可判断仪器B是冷凝管,起冷凝回流的作用。硫粉难溶于水微溶于乙醇,所以硫粉在反应前用乙醇湿润的目的是使硫粉易于分散到溶液中,有利于硫粉和Na2SO3溶液充分接触,加快反应速率;
(2)通过蒸发浓缩,冷却结晶,过滤洗涤,干燥等步骤得到溶液中的溶质固体;
(3)S2O32具有还原性,能够被氧气氧化成硫酸根离子,滤液中除Na2S2O3和可能未反应完全的Na2SO3外,存在被氧化产物硫酸钠,所以可能存在的杂质是硫酸钠,其检测的方法依据硫酸根离子检验:取出少许溶液,加盐酸至酸性后,取上层清液或过滤除去S,再加BaCl2溶液。则加入的盐酸发生两个反应的化学方程式为:Na2SO3+2HCl═SO2↑+H2O+2NaCl,Na2S2O3+2HCl=S↓+SO2↑+H2O+2NaCl,取出少许溶液,加稀盐酸至酸性,静置后,取上层清液,再加BaCl2溶液,若出现浑浊则含Na2SO4,反之不含;
(4)碘水呈酸性,应用酸式滴定管盛装,第2次滴定的误差较大,舍去,碘的物质的量为:0.0500molL-l×![]() L=0.00154mol
L=0.00154mol
2S2O32-+I2═S4O62-+2I-
2 1
x 0.00154mol
解得:x=0.00308mol,故Na2S2O35H2O的物质的量为0.00308mol,质量为:0.00308mol×248g/mol=0.76384g,则称取7.40g产品,配制成250mL溶液中,Na2S2O35H2O的质量为=0.76384g×![]() =7.6384g,故产品的纯度为:
=7.6384g,故产品的纯度为:![]() ×100%=103.2%,碘单质有强的氧化性,Na2SO3具有还原性,Na2SO3会和I2发生反应,从而影响纯度。
×100%=103.2%,碘单质有强的氧化性,Na2SO3具有还原性,Na2SO3会和I2发生反应,从而影响纯度。

 阅读快车系列答案
阅读快车系列答案