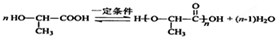题目内容
有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1)若②、⑦、⑧三种元素在周期表中相对位置如下:
| ② | |||
| ⑦ | ⑧ |
②与⑦、②与⑧形成的液体化合物是常见的重要溶剂,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:_________________________________(用化学式表示)。

|
|
换反应,反应b为化合反应。见右图示转化关系
推测:
戊可能为:__________________、___________________(列举合适的两例)。
若甲是O2、乙是N2H4,反应a是在强碱性溶液中进行的的原电池反应,则负极发生的电极反应式为:_______________________________________。
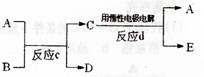 (3)若右下图中A、B、C、D、E分别是上述10种元素中的某些元素组成的单质或其中两种元素组成的化合物.已知:A是常见的金属
(3)若右下图中A、B、C、D、E分别是上述10种元素中的某些元素组成的单质或其中两种元素组成的化合物.已知:A是常见的金属
单质,反应C为置换反应类型。
若反应c是用A作电极,在B的水溶液中进
行电解反应,它们有如右图示转化关系。则反
应d中阴极的电极反应式为:________________________________________
若反应c是在高温下进行的,且为工业上有重要应用价值的放热反应,当物质C是一种两性化合物,则反应c的化学方程式为:________________________________________

解析:
(1)首先准确判断各元素,然后根据非金属强弱与其最高价氧化物对应水合物的酸性强弱的关系确定次序;(2)重在考查学生对元素化合物的掌握情况;(3)根据“高温”、“工业上有重要价值”、“放热”反应等关键信息确定此反应为铝热反应。

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
 有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.
有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.