题目内容
 有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.
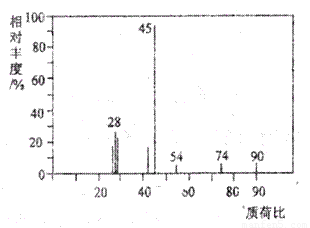
有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.(1)A分子的质谱图如图所示,从图中可知其相对分子质量是90,则A的分子式是
C3H6O3
C3H6O3
.(2)A能与NaHCO3溶液发生反应,A一定含有的官能团名称是
羧基
羧基
.(3)A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则A的结构简式是
CH3CH(OH)COOH
CH3CH(OH)COOH
.(4)0.1mol A与足量Na反应,在标准状况下产生H2的体积是
2.24
2.24
L.(5)A在一定条件下可聚合得到一种聚酯,用于制造手术缝合线,其反应的化学方程式是


分析:(1)根据浓硫酸增重5.4g为水的质量,碱石灰增重13.2g为二氧化碳的质量,根据质量守恒计算氧元素的质量,进而计算最简式,再结合相对分子质量计算分子式;
(2)A能与NaHCO3溶液发生反应,A一定含有羧基(-COOH);
(3)分子的核磁共振氢谱有4个峰,说明分子中含有4种H原子,峰面积之比是1:1:1:3,则4种H原子的数目之比为1:1:1:3,结合分子式判断分子结构;
(4)结合有机物的结构判断与钠的反应,进而计算生成氢气的体积;
(5)根据有机物A的结构与酯化反应原理书写反应方程式.
(2)A能与NaHCO3溶液发生反应,A一定含有羧基(-COOH);
(3)分子的核磁共振氢谱有4个峰,说明分子中含有4种H原子,峰面积之比是1:1:1:3,则4种H原子的数目之比为1:1:1:3,结合分子式判断分子结构;
(4)结合有机物的结构判断与钠的反应,进而计算生成氢气的体积;
(5)根据有机物A的结构与酯化反应原理书写反应方程式.
解答:解:(1)5.4g水的物质的量为
=0.3mol,n(H)=0.6 mol,13.2g二氧化碳的物质的量为
=0.3mol,n(C)=n(CO2)=0.3 mol,此有机物9.0g含O元素质量:9.0g-0.6g-0.3×12 g=4.8 g,n(O)=
=0.3 mol,故n(C):n(H):n(O)=0.3mol:0.6mol:0.3mol=1:2:1,即实验式为CH2O,设分子式为(CH2O)n,A的相对分子质量为90,可得30n=90,解得:n=3,故有机物A为C3H6O3;
故答案为:C3H6O3;
(2)A能与NaHCO3溶液发生反应,A一定含有羧基(-COOH);
故答案为:羧基;
(3)有机物A为C3H6O3,核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则分子中4种H原子的数目为1、1、1、3,分子中含有1个-COOH、1个-CH3、1个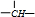 CH、1个-OH,有机物A的结构简式为CH3CH(OH)COOH;
CH、1个-OH,有机物A的结构简式为CH3CH(OH)COOH;
故答案为:CH3CH(OH)COOH;
(4)有机物A含有-OH和-COOH,都能与Na反应生成氢气,反应的化学方程式为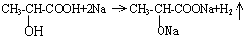 ,由方程式可知0.1molA与足量Na反应生成氢气0.1mol,在标准状况下产生H2的体积是0.1mol×22.4L/mol=2.24L;
,由方程式可知0.1molA与足量Na反应生成氢气0.1mol,在标准状况下产生H2的体积是0.1mol×22.4L/mol=2.24L;
故答案为:2.24L
(5)有机物A含有-OH和-COOH,聚合反应得到聚酯的反应方程式为 ;
;
故答案为: .
.
| 5.4g |
| 18g/mol |
| 13.2g |
| 44g/mol |
| 4.8g |
| 16g/mol |
故答案为:C3H6O3;
(2)A能与NaHCO3溶液发生反应,A一定含有羧基(-COOH);
故答案为:羧基;
(3)有机物A为C3H6O3,核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则分子中4种H原子的数目为1、1、1、3,分子中含有1个-COOH、1个-CH3、1个
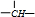 CH、1个-OH,有机物A的结构简式为CH3CH(OH)COOH;
CH、1个-OH,有机物A的结构简式为CH3CH(OH)COOH;故答案为:CH3CH(OH)COOH;
(4)有机物A含有-OH和-COOH,都能与Na反应生成氢气,反应的化学方程式为
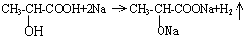 ,由方程式可知0.1molA与足量Na反应生成氢气0.1mol,在标准状况下产生H2的体积是0.1mol×22.4L/mol=2.24L;
,由方程式可知0.1molA与足量Na反应生成氢气0.1mol,在标准状况下产生H2的体积是0.1mol×22.4L/mol=2.24L;故答案为:2.24L
(5)有机物A含有-OH和-COOH,聚合反应得到聚酯的反应方程式为
 ;
;故答案为:
 .
.点评:不同考查有机物分子式与结构式的确定、官能团的性质等,难度中等,掌握燃烧法利用质量守恒确定有机物实验式.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目