题目内容
【题目】将0.01mol I2和0.01mol H2置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为456 kPa。体系中存在以下反应关系:
I2(g)![]() 2I(g) △H1 Kp1=2.00
2I(g) △H1 Kp1=2.00
HI(g)![]() I(g)+H(g) △H2 Kp2
I(g)+H(g) △H2 Kp2
H2(g)![]() 2H(g) △H3 Kp3=8×10-6
2H(g) △H3 Kp3=8×10-6
I2(g)+H2(g)![]() 2HI(g) △H4 Kp4
2HI(g) △H4 Kp4
回答下列问题:
(1) △H4与△H1、△H2、△H3的关系是_________________________。
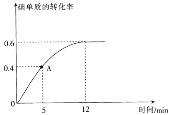
(2) I2(g)+H2(g)![]() 2HI(g)反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时,v正________(填“>”“<”“=”)v逆,前5minHI的生成率v(HI)=_____________________。
2HI(g)反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时,v正________(填“>”“<”“=”)v逆,前5minHI的生成率v(HI)=_____________________。
(3)达到平衡状态时,氢气的物质的量分数是________________;Kp4=________________(Kp为用平衡分压代替浓度表示的平衡常数,平衡分压=总压×物质的量分数)。
(4)下列说法能说明该体系达到平衡状态的是________________。
A.颜色不再变化
B.气体平均相对分子质量不再变化
C.气体密度不再变化
D.温度不再变化
(5)HI是一种强酸,常温下将1.0mol·L-1的HI溶液和amol·L-1的氨水等体积混合后,溶液呈中性此时溶液中离子浓度的大小关系是________________。
【答案】△H4=△H1+△H3-2△H2 > 8×10-4mol·L-1·min-1 0.2(或20%) 9 AD c(NH4+)=c(I-)>c(H+)=c(OH-)
【解析】
(1)根据盖斯定律:(1)I2(g)![]() 2I(g) △H1;(2)HI(g)
2I(g) △H1;(2)HI(g)![]() I(g)+H(g) △H2
I(g)+H(g) △H2
(3)H2(g)![]() 2H(g) △H3;由(1)-(2)+(3)得(4):I2(g)+H2(g)
2H(g) △H3;由(1)-(2)+(3)得(4):I2(g)+H2(g)![]() 2HI(g) 即△H4=△H1-2△H2+△H3;答案:△H4=△H1+△H3-2△H2。
2HI(g) 即△H4=△H1-2△H2+△H3;答案:△H4=△H1+△H3-2△H2。
(2) A点时反应没有达到平衡仍然向正反应方向进行,所以A点时v正>v逆;根据三段式
I2(g) + H2(g)![]() 2HI(g)
2HI(g)
初始量(mol) 0.01 0.01 0
变化量(mol) x x 2x
5min量(mol) 0.01-x 0.01-x 2x
由图像知5min时碘单质的转化率为0.4,所以x/0.01=0.4,x=0.004mol, 前5minHI的生成率=(0.004mol![]() 2)/2L
2)/2L![]() 5min=0.0008 mol·L-1·min-1;答案:>;8×10-4mol·L-1·min-1。
5min=0.0008 mol·L-1·min-1;答案:>;8×10-4mol·L-1·min-1。
(3) 达到平衡时碘单质的转化率为0.6,所以x/0.01=0.6,x=0.006mol, 根据三段式
I2(g) + H2(g)![]() 2HI(g)
2HI(g)
初始量(mol) 0.01 0.01 0,
变化量(mol) 0.006 0.006 0.012
平衡量(mol) 0.004 0.004 0.012
达到平衡状态时,氢气的物质的量分数是0.004/(0.004+0.004+0.012)![]() 100
100![]() = 20% ;
= 20% ;
平衡分压=总压×物质的量分数, 平衡时总压强为456 kPam,Kp4=c2(HI)/c(I2 )![]() c(H2)= (456
c(H2)= (456![]() 0.04)2 /(456
0.04)2 /(456![]() 0.04)
0.04)![]() (456
(456![]() 0.04)=9答案:20%;9。
0.04)=9答案:20%;9。
(4) 由I2(g) + H2(g)![]() 2HI(g)反应知A.颜色不再变化,说明I2的浓度不在改变,反应体系达到平衡状态,故A正确;B.气体平均相对分子质量M=m/n,因为m和n不变,M为定值,所以气体平均相对分子质量不再变化,不能说明反应体系达到平衡状态,故B错误;C.因为反应物和生物都是气体,在恒容条件下由
2HI(g)反应知A.颜色不再变化,说明I2的浓度不在改变,反应体系达到平衡状态,故A正确;B.气体平均相对分子质量M=m/n,因为m和n不变,M为定值,所以气体平均相对分子质量不再变化,不能说明反应体系达到平衡状态,故B错误;C.因为反应物和生物都是气体,在恒容条件下由![]() =m/v知气体密度是定值,所以气体密度不再变化不能说明反应体系达到平衡状态,故C错误;D.发生化学变化伴随着能量变化,所以温度不再变化说明反应体系达到平衡状态,故D正确;答案:AD。
=m/v知气体密度是定值,所以气体密度不再变化不能说明反应体系达到平衡状态,故C错误;D.发生化学变化伴随着能量变化,所以温度不再变化说明反应体系达到平衡状态,故D正确;答案:AD。
(5)HI是一种强酸,氨水为弱碱,常温下将1.0mol·L-1的HI溶液和amol·L-1的氨水等体积混合后,溶液呈中性,溶质为NH4I和氨水,根据电荷守恒,c(H+)+c(NH4+)=c(I-)+c(OH-) 因为cH+)= c(OH-),所以c(NH4+)=c(I-)。答案: c(NH4+)=c(I-)>c(H+)=c(OH-)。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】向物质X中逐渐加入(或通入)Y溶液,生成沉淀的量与加入Y的物质的量关系如图所示,下表中符合图示情况的是

A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A.AB.BC.CD.D