题目内容
Ⅰ.已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质.

(1)步骤1的主要操作是________,需用到的玻璃仪器除烧杯外有________.
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式)________.
(3)步骤2中在分离Hg和固体残渣时,在封闭体系中加热、冷凝回收的方法,原因是________
(4)步骤3之后在B中加入液体混合物X(稀H2SO4和一种绿色氧化剂),仅生成硫酸铜溶液,无其它物质生成,反应方程式是________.
(5)步骤4中涉及的操作是:蒸发浓缩、________、过滤、烘干.
Ⅱ.在CuSO4溶液中加入适量KI溶液,有白色沉淀CuI生成,写出反应的离子方程式________.
现以下列电解池装置电解KI溶液:

请回答:电解开始不久时,电解池中的现象是________.
答案:
解析:
解析:
Ⅰ:(1)过滤(1分) 漏斗、玻璃棒(各1分,共2分)
(2)Cu(1分)
(3)因为Hg有挥发性,且有毒.(2分)
(4)Cu+H2O2+H2SO4![]() CuSO4+2H2O(2分)
CuSO4+2H2O(2分)
(5)冷却结晶(或结晶)(2分)
Ⅱ:2Cu2++4I-![]() 2CuI↓+I2(2分)
2CuI↓+I2(2分)
阴极区溶液呈红色,而阳极区溶液呈蓝色,并在电解池中出现(白色)沉淀(白色可不写).(3分)

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
某科研小组从含有较多Ag+、Fe3+、Al3+的工业废水中,按如图所示方法分离和提取金属单质:
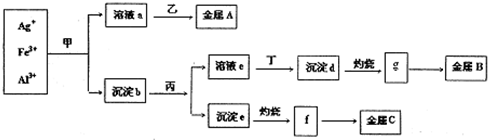
已知:实验室甲、乙、丙、丁四种物质只能从氨水、碳酸铵、氢氧化钠、稀硫酸、葡萄糖五种溶液中选择,也可以用这五种溶液来制备.对该实验分析正确的是( )

已知:实验室甲、乙、丙、丁四种物质只能从氨水、碳酸铵、氢氧化钠、稀硫酸、葡萄糖五种溶液中选择,也可以用这五种溶液来制备.对该实验分析正确的是( )
| A、金属A、B、C分别为Ag、Fe、Al | B、g、f都为氧化物,工业上均采用电解g与f获得对应金属单质 | C、沉淀b为混合物,主要成分为沉淀d和沉淀e | D、甲是氢氧化钠,丁为稀硫酸 |

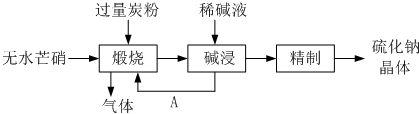
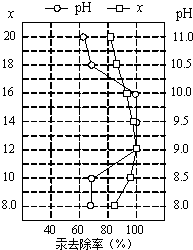 (4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示).为使除汞效果最佳,应控制的条件是
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示).为使除汞效果最佳,应控制的条件是