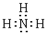题目内容
有
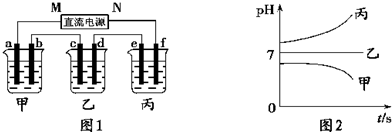
A、B、C三种电解质溶液分别装在三个烧杯中,插有石墨电极,并按如图所示安装装置,在电路中连接密闭开关K后,测得各支路电流强度IⅠ≈IⅡ(其中IⅡ略小).若撤去B,测得IA回答下列问题:

(1)通过实验,请你推断A、B、C三种溶液溶质的化学式分别为:A:________,B:________,C:________.
(2)若向C溶液中滴入酚酞呈红色,则C是________.
(3)已知:H2O![]() H++OH-,根据上述实验,请你判断,若将A、B、C分别等体积进行两两混合,能使H2O的电离程度最大的组合为________(填“AB”、“BC”或“AC”).试用离子方程式解释其原因________.
H++OH-,根据上述实验,请你判断,若将A、B、C分别等体积进行两两混合,能使H2O的电离程度最大的组合为________(填“AB”、“BC”或“AC”).试用离子方程式解释其原因________.
答案:
解析:
解析:
答案:

讲析:


练习册系列答案
相关题目