题目内容
20.2013年4月24日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行.能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是( )| A. | 点燃,能燃烧的是矿物油 | |
| B. | 加入足量氢氧化钠溶液共热,不分层的是地沟油 | |
| C. | 加入水中,浮在水面上的是地沟油 | |
| D. | 测定沸点,有固定沸点的是矿物油 |
分析 地沟油中含油脂,与碱溶液反应,而矿物油不与碱反应,混合后分层,以此来解答.
解答 解:A.地沟油、矿物油均能燃烧,不能区别,故A错误;
B.加入足量氢氧化钠溶液共热,不分层的是地沟油,分层的为矿物油,现象不同,能区别,故B正确;
C.地沟油、矿物油均不溶于水,且密度均比水小,不能区别,故C错误;
D.地沟油、矿物油均为混合物,没有固定沸点,不能区别,故D错误;
故选B.
点评 本题考查有机物的区别,明确地沟油、矿物油的成分及性质是解答本题的关键,侧重有机物性质的考查,题目难度不大.

练习册系列答案
相关题目
10. A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.
请回答下列问题:
(1)Z的化学式为NO2.
(2)E的单质与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO.
(3)W空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.W空气燃料电池放电时,正极反应式为O2+2H2O+4e-═4OH-,负极反应式为N2H4+4OH--4e-═N2+4H2O.
(4)将一定量的A2、B2的混合气体放入1L密闭容器中,在500℃、2×107Pa下达到平衡.测得平衡气体的总物质的量为0.50mol,其中A2为0.3mol,B2为0.1mol.则该条件下A2的平衡转化率为33.3%.
 A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.| B | D | |
| E |
(1)Z的化学式为NO2.
(2)E的单质与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO.
(3)W空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.W空气燃料电池放电时,正极反应式为O2+2H2O+4e-═4OH-,负极反应式为N2H4+4OH--4e-═N2+4H2O.
(4)将一定量的A2、B2的混合气体放入1L密闭容器中,在500℃、2×107Pa下达到平衡.测得平衡气体的总物质的量为0.50mol,其中A2为0.3mol,B2为0.1mol.则该条件下A2的平衡转化率为33.3%.
11.下列事实与氢键有关的是( )
| A. | 水结成冰体积膨胀,密度变小 | |
| B. | CH4、SiH4、GeH4、SnH4的熔点随相对分子质量增大而升高 | |
| C. | He、Ne、Ar、Kr、Xe在水中的溶解度逐渐增大 | |
| D. | 水加热到很高的温度都难以分解 |
8.下列有机物命名正确的是( )
| A. | 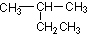 2-乙基丙烷 2-乙基丙烷 | B. | 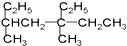 3,5-二甲基-3-乙基庚烷 3,5-二甲基-3-乙基庚烷 | ||
| C. | 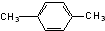 间二甲苯 间二甲苯 | D. | 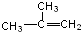 2-甲基-2-丙烯 2-甲基-2-丙烯 |
15.下列反应属于吸热反应的是( )
| A. | 燃烧木炭 | B. | 酸碱中和反应 | ||
| C. | 锌粒与稀硫酸反应制取H2 | D. | Ba(OH)2•8H2O与NH4Cl反应 |
5.锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是2Zn+O2=2ZnO.下列有关它的说法正确的是( )
| A. | 锌为电池负极,发生氧化反应 | |
| B. | 电解质溶液是酸性溶液 | |
| C. | 电池工作时,氧气与锌直接化合,生成氧化锌 | |
| D. | 负极发生的反应是:Zn-2e-+H2O=ZnO+2H+ |
12.在20℃时,某气态烃与氧气混合装入密闭容器中,点燃爆炸后,又恢复到20℃.此时容器内气体的压强为反应前的一半,经NaOH溶液吸收后,容器内几乎真空.此烃的化学式可能是( )
| A. | CH4 | B. | C3H4 | C. | C2H2 | D. | C3H8 |
9.下列四组物质中互为同素异形体的是( )
| A. | 纯碱与苏打 | B. | 12CO和14CO | ||
| C. | CH3CHO与 | D. | 金刚石和富勒烯(C60) |
11.如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
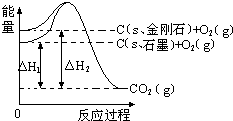

| A. | 石墨和金刚石的转化是物理变化 | |
| B. | C(s、石墨)═C(s、金刚石)△H=+1.9 kJ•mol-1 | |
| C. | 金刚石的稳定性强于石墨 | |
| D. | 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |