题目内容
7.已知 H2(g)+Cl2(g)=2HCl(g)反应放出热量为Q1,H2(g)+Br2(g)=2HBr(g)反应放出热量为Q2 有关上述反应的叙述正确的是( )| A. | Q1<Q2 | |
| B. | 生成物总能量均高于反应物总能量 | |
| C. | 生成1 mol HCl气体时放出Q1热量 | |
| D. | 1 mol HBr(g)具有的能量大于1 mol HBr(l)具有的能量 |
分析 两个反应都是放热反应,生成物的总能量低于反应物的总能量;由热化学方程式可知,生成2mol氯化氢放出的热量才是Q1;物质在气态时具有的能量一般高于液态和固态时,以此解答该题.
解答 解:A.因为Cl2比Br2活泼,Cl-Cl键能较大,放出的热量更多,应为Q1>Q2,故A错误;
B.两个反应都是放热反应,生成物的总能量低于反应物的总能量,故B错误;
C.由热化学方程式可知,生成2mol氯化氢放出的热量才是Q1,故C错误;
D.物质在气态时具有的能量一般高于液态和固态时,则1molHBr(g)具有的能量高于1molHBr(l)具有的能量,故D正确.
故选D.
点评 本题考查化学能与热能的转化,题目难度不大,易错点为A,注意比较反应热的角度,可从键能的角度比较.

练习册系列答案
相关题目
17.下列说法不正确的是( )
| A. | Na2O2能与CO2反应,可用作呼吸面具的供氧剂 | |
| B. | 硅是半导体材料,可用于制备光导纤维 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| D. | Al2O3熔点高,可用于制作耐高温仪器 |
2.元素的性质呈周期性变化的根本原因是( )
| A. | 元素的原子半径呈周期性变化 | |
| B. | 元素原子量的递增,量变引起质变 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素原子的核外电子排布呈周期性变化 |
12.在0.1mol•L-1CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )
| A. | 加入少量CH3COONa固体,平衡向正反应方向移动 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 通入少量HCl气体,溶液中pH值增大 | |
| D. | 加入水时,平衡向逆反应方向移动 |
19.江苏省已开始大力实施“清水蓝天”工程.下列不利于“清水蓝天”工程实施的是( )
| A. | 将废旧电池深埋,防止污染环境 | |
| B. | 加强城市生活污水脱氮除磷处理,遏制水体富营养化 | |
| C. | 积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 | |
| D. | 大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染 |
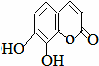 瑞香是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示,回答下列问题.
瑞香是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示,回答下列问题.