��Ŀ����
����Ŀ�������������������ճ�������������Ҫ�����á�
(1)�о���������200����ѹǿ����200MPaʱ����ʹ�ô������������˳���ϳɡ�����ҵ�Ϻϳ�NH3�������¶�500��ѹǿ20~50MPa�������½��У���֪�ϳɰ�Ϊ���ȷ�Ӧ���Է���ԭ��_____________��
(2)��ҵ�ϳ�����4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)�������ᡣ��ͬ�������£���2L�ķ�Ӧ�����г���2mol NH3��2.75molO2��ƽ��ʱNH3ת����Ϊ50%������¶���K=___�������¶Ȳ��䣬����ѹǿ����ƽ�ⳣ��_____(����������������С������������)�������������䣬���д�ʩһ������������ת���ʵ���____��
4NO(g)+6H2O(g)�������ᡣ��ͬ�������£���2L�ķ�Ӧ�����г���2mol NH3��2.75molO2��ƽ��ʱNH3ת����Ϊ50%������¶���K=___�������¶Ȳ��䣬����ѹǿ����ƽ�ⳣ��_____(����������������С������������)�������������䣬���д�ʩһ������������ת���ʵ���____��
A�����Ͱ���Ũ�� B������������� C�������¶� D���Ƴ�ˮ���� E��ѡ����ʵĴ���
(3)��֪��A��2NH3(g)+CO2(g)NH2COONH4(l) ��H=-123kJ/mol
B��NH2COONH4(l)(NH2)2CO(g)+H2O(g) ��H= +50kJ/mol
���ڹ�ҵ�����У�������������A��B�����ϳɵģ���ҵ���ɰ����������̼�ϳ����ص��Ȼ�ѧ��Ӧ����ʽΪ��_______________��
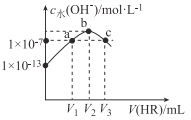
�����غϳɹ�����ͨ�������¶ȡ�NH3��CO2�����ʵ�����(��̼��a)�����������CO2��ת���ʡ���ͼ������������һ������ͬ��̼��������CO2ƽ��ת�������¶ȵĹ�ϵͼ����ͼ��֪���¶�һ��ʱ��aֵԽ��CO2ת����Խ����ԭ����______����aһ��ʱ��CO2ƽ��ת���ʳ�����������С�����ƣ���ԭ��Ϊ_______��
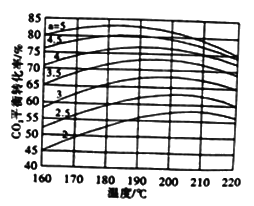
���𰸡��¶�̫�ͷ�Ӧ̫����ѹǿ̫����豸Ҫ��ϸߣ�ѹǿ̫��ת�����½� 0.75 ���� ABD 2NH3(g)+CO2(g)(NH2)2CO(g) +H2O(g) ��H=-73kJ/mol aֵԽ��NH3ռ��Ӧ������ߣ�ƽ���������ƶ������CO2ת���� ǰ���B��ӦΪ�������أ��¶����ߣ��ٽ�B��Ӧ�������ƶ�������A��ӦΪ�������أ�A��Ӧ�������ƶ�
��������
(1)�ϳɰ�Ϊ���������С�ķ��ȷ�Ӧ����Ӱ�췴Ӧ���ʺ�ƽ���ƶ������ط����ϳɰ���Ӧ������������ѡ��
(2)���ݸ����ʵ���ʼ���Ͱ�����ת���ʣ��������ʽ����������ʵ�ƽ��Ũ�ȣ��Ӷ�������÷�Ӧ��ƽ�ⳣ����ƽ�ⳣ�����¶ȵĺ������ݴ˷���ѹǿ��ƽ�ⳣ����Ӱ�죻����Ӱ��ƽ���ƶ������ؽ��з�������ת���ʵı仯�����
(3)�ٸ��ݸ�˹���ɽ��м��㣻
��ǰ���B��ӦΪ�������أ��¶����ߣ��ٽ�B��Ӧ�������ƶ�������A��ӦΪ�������أ�A��Ӧ�������ƶ����ݴ˽��з�����
(1)�ϳɰ���ȻΪ���ȷ�Ӧ�������¶�̫�ͷ�Ӧ̫������λʱ���ڵ�ת���ʵͣ��÷�ӦΪ�����С�ķ�Ӧ��ѹǿ̫��ת�����½�����ѹǿ̫�߶��豸Ҫ��ϸߣ�����ѡ��500��ѹǿ20~50MPa��������
(2)��ʼͶ��Ϊ2mol NH3��2.75molO2��ƽ��ʱNH3ת����Ϊ50%����ƽ��ʱ��n(NH3)=1mol�����ݷ�Ӧ����ʽ��֪��n(O2)=1.25mol����n(NO)=1mol����n(H2O)=1.5mol����ƽ��ʱ��λ�����ʵ���Ϊn(NH3)=(2-1)mol�� n(O2)=(2.75-1.25)mol��n(NO)=1mol��n(H2O)=1.5mol�����������Ϊ2L����NH3�� O2��NO��H2O��Ũ�ȷֱ�Ϊ0.5mol/L��0.75mol/L��0.5mol/L��0.75mol/L��ƽ�ⳣ��K=![]() =0.75��
=0.75��
�¶Ȳ���ƽ�ⳣ�����䣬���Ա����¶Ȳ��䣬����ѹǿ����ƽ�ⳣ�����䣻
A�����Ͱ���Ũ�ȣ��൱������������Ũ�ȣ�������ת��������A�������⣻
B�������������ѹǿ��С���÷�ӦΪ����ϵ��֮������ķ�Ӧ������ƽ��������ƶ���������ת��������B�������⣻
C���÷�Ӧ�ʱ�δ֪�����ж��¶ȶ�ƽ���Ӱ�죬��C���������⣻
D���Ƴ�ˮ��������ʹƽ�������ƶ���������ת��������D�������⣻
E������ֻ�ı䷴Ӧ���ʣ����ı䷴Ӧ��ƽ�⣬������ת���ʲ��䣬��E���������⣻
��������ѡABD��
(3)����֪A��2NH3(g)+CO2(g)NH2COONH4(l)��H=-123kJ/mol
B��NH2COONH4(l)(NH2)2CO(g)+H2O(g)��H= +50kJ/mol
���ݸ�˹����A+B�ɵ�2NH3(g)+CO2(g)(NH2)2CO(g) +H2O(g) ��H=-123kJ/mol+50kJ/mol=-73kJ/mol��
��aֵԽ��NH3ռ��Ӧ������ߣ�ƽ���������ƶ������CO2ת���ʣ�ǰ���B��ӦΪ�������أ��¶����ߣ��ٽ�B��Ӧ�������ƶ�������A��ӦΪ�������أ�A��Ӧ�������ƶ�������CO2ƽ��ת���ʳ�����������С�����ơ�

 ��ǰ�κ�ͬ����ϰϵ�д�
��ǰ�κ�ͬ����ϰϵ�д� ����С��ҵϵ�д�
����С��ҵϵ�д� �Ƹ�С״Ԫ����������ϰ��ϵ�д�
�Ƹ�С״Ԫ����������ϰ��ϵ�д� �ɹ�ѵ���ƻ�ϵ�д�
�ɹ�ѵ���ƻ�ϵ�д� ����ѵ����ֱͨ�п�����ϵ�д�
����ѵ����ֱͨ�п�����ϵ�д�����Ŀ���ڲ�ͬ�¶��£��� 2 L�ܱ������м���1 mol NO(g)��1 mol����̿(C)��������Ӧ:2NO(g)+C(s) ![]() N2(g)+CO2(g)����H=-213.5 kJ��mol-1���ﵽƽ��ʱ���������¡�
N2(g)+CO2(g)����H=-213.5 kJ��mol-1���ﵽƽ��ʱ���������¡�
�¶�/�� | n(C)/mol | n(CO2)/mol |
t1 | 0.70 | |
t2 | 0.25 |
����˵������ȷ���ǣ� ��
A.������Ϣ����֪:t1<t2
B.t1�� ʱ���÷�Ӧ��ƽ�ⳣ��K=![]()
C.t2�� ʱ������Ӧ��ƽ�������С�������ݻ���c(N2)��c(NO)����
D.t1�� ʱ������ʼʱ��Ӧ�����������Сһ�룬ƽ���NO��ת���ʼ�С