题目内容
在温度、容积相同的2个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知N2(g)+3H2(g)
 2NH3(g) △H=-92.4 kJ·mol-1)
2NH3(g) △H=-92.4 kJ·mol-1)
|
容器 |
甲 |
乙 |
|
反应物投入量 |
1 mol N2、3 mol H2 |
4 mol NH3 |
|
NH3的浓度(mol·L-1) |
c1 |
c2 |
|
反应的能量变化 |
放出a kJ |
吸收b kJ |
|
气体密度 |
ρ1 |
ρ2 |
|
反应物转化率 |
α1 |
α2 |
下列说法正确的是
A.c1<c2<2 c1 B.a+b>92.4 C.α1 +α2=1 D.ρ2=2ρ1
BD
【解析】
试题分析:为了便于分析,构建了甲、丙、丁两三个等效平衡。
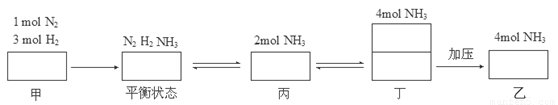
A、平衡后丁加压为乙,平衡逆向移动,NH3的浓度变大,故有c2>2 c1,错误;B、设丙到平衡状态吸收的能量为c,则有a+c=92.4,因为乙的NH3的量多,反应的多,吸收的热量多,故有a+b>92.4,正确;C、设丙的转化率为α3,,则有α1 +α3=1,乙的转化率低于丙,故α1 +α2<1,错误;D、甲与乙的体积相等,质量乙是甲的两倍,故 ρ2=2ρ1,正确。
考点:考查化学平衡的移动的知识。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案在温度、容积相同的2个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
|
已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,在温度、容积相同的2个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
|
在温度、容积相同的2个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
|
容器 |
甲 |
乙 |
|
反应物投入量 |
1 mol N2、3 mol H2 |
4 mol NH3 |
|
NH3的浓度(mol·L-1) |
c1 |
c2 |
|
反应的能量变化 |
放出a kJ |
吸收b kJ |
|
气体密度 |
ρ1 |
ρ2 |
|
反应物转化率 |
α1 |
α2 |
 (已知N2(g)+3H2(g)
2NH3(g);ΔH=-92.4 kJ·mol-1),下列说法正确的是(
)
(已知N2(g)+3H2(g)
2NH3(g);ΔH=-92.4 kJ·mol-1),下列说法正确的是(
)
A.c1<c2<2c1 B.a+b>92.4 C.α1+α 2=1 D.ρ2=2ρ1
已知:N2(g)+3H2(g)
 2NH3(g) △H =-92.4 kJ·mol-1,在温度、容积相同的2个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
2NH3(g) △H =-92.4 kJ·mol-1,在温度、容积相同的2个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
|
容器 |
容器1 |
容器2 |
|
反应物投入量 始态 |
1mol N2、3mol H2 |
2mol NH3 |
|
NH3的平衡浓度/mol·L-1 |
cl |
c2 |
|
反应的能量变化 |
放出a kJ |
吸收b kJ |
|
体系压强/Pa |
p1 |
p 2 |
|
反应物转化率 |
α1 |
α2 |
下列说法不正确的是 ( )
A. cl 一定等于c2 B.a + b = 92.4
C. p1 一定等于p2 D.α1 一定等于α2