题目内容
已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,在温度、容积相同的2个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
|
分析:甲容器反应物投入1molN2、3molH2,乙容器反应物投入量2molNH3,恒温且乙容器容积和甲容器相同,则甲容器与乙容器也是等效平衡.
A.甲容器反应物投入1molN2、3molH2,乙容器反应物投入量2molNH3,达到相同平衡,则c2=c1;
B.若乙中开始投入2molNH3,则甲与乙是等效的,甲与乙的反应的能量变化之和为92.4kJ;
C.乙中混合气体的质量和甲相同,体积相同,密度之比等于质量之比;
D.若乙中开始投入2molNH3,则甲与乙是等效的,甲与乙的反应物转化率之和为1.
A.甲容器反应物投入1molN2、3molH2,乙容器反应物投入量2molNH3,达到相同平衡,则c2=c1;
B.若乙中开始投入2molNH3,则甲与乙是等效的,甲与乙的反应的能量变化之和为92.4kJ;
C.乙中混合气体的质量和甲相同,体积相同,密度之比等于质量之比;
D.若乙中开始投入2molNH3,则甲与乙是等效的,甲与乙的反应物转化率之和为1.
解答:解:甲容器反应物投入1molN2、3molH2,乙容器反应物投入量2molNH3,恒温且乙容器容积和甲容器相同,则甲容器与乙容器也是等效平衡.
A.甲容器反应物投入1molN2、3molH2,乙容器反应物投入量2molNH3,达到相同平衡,则c2=c1 ,故A正确;
B.若乙中开始投入2molNH3,则甲与乙是等效的,甲与乙的反应的能量变化之和为92.4kJ,故a+b=92.4,故B正确;
C.甲乙中混合气体的质量相同,体积相同,密度之比等于质量之比,故ρ2=ρ1,故C正确;
D.若乙中开始投入2molNH3,则甲与乙是等效的,甲与乙的反应物转化率之和为1,故α1+α2=1,但α1不一定等于α2,故D错误;
故选D.
A.甲容器反应物投入1molN2、3molH2,乙容器反应物投入量2molNH3,达到相同平衡,则c2=c1 ,故A正确;
B.若乙中开始投入2molNH3,则甲与乙是等效的,甲与乙的反应的能量变化之和为92.4kJ,故a+b=92.4,故B正确;
C.甲乙中混合气体的质量相同,体积相同,密度之比等于质量之比,故ρ2=ρ1,故C正确;
D.若乙中开始投入2molNH3,则甲与乙是等效的,甲与乙的反应物转化率之和为1,故α1+α2=1,但α1不一定等于α2,故D错误;
故选D.
点评:本题考查化学平衡影响因素、等效平衡、化学平衡的计算,题目计算量较大,难度较大,关键是构建平衡建立的等效途径.

练习册系列答案
相关题目
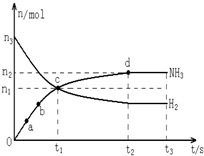 自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:
自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题: