题目内容
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:
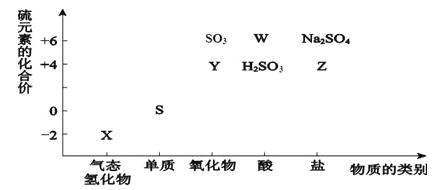
(1)X的化学式为__________,Y的化学式为__________。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为_________。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是________(填序号)。
A.Na2S + S B.Na2SO3 + S C.Na2SO3 + Na2SO4 D.SO2 + Na2SO4
(4)将X与SO2混合,可生成淡黄色固体。该反应的氧化产物与还原产物的质量之比为_____。
【答案】 H2S SO2 Cu+2H2SO4(浓)![]() CuSO4+SO2 ↑+2H2O B 2:1
CuSO4+SO2 ↑+2H2O B 2:1
【解析】(1)X中S元素化合价是-2价,所以化学式为H2S,Y中S元素化合价是+4价,则其氧化物的化学式为SO2。(2)W的浓溶液是浓硫酸,与铜单质在加热条件下发生反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。(3)Na2S2O3中S元素化合价是+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2,A中S化合价都小于2,C、D中S的化合价都大于2,B符合题意,答案选B;(4)X为H2S,与SO2混合可生成淡黄色固体,二氧化硫氧化硫化氢生成淡黄色沉淀S和水:2H2S+SO2=3S↓+2H2O,反应中硫元素化合价-2价变化为0价,H2S做还原剂,+4价变化为0价,二氧化硫做氧化剂,则该反应的氧化剂与还原剂的物质的量之比为1:2,所以该反应的氧化产物与还原产物的质量之比为2:1。
CuSO4+SO2↑+2H2O。(3)Na2S2O3中S元素化合价是+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2,A中S化合价都小于2,C、D中S的化合价都大于2,B符合题意,答案选B;(4)X为H2S,与SO2混合可生成淡黄色固体,二氧化硫氧化硫化氢生成淡黄色沉淀S和水:2H2S+SO2=3S↓+2H2O,反应中硫元素化合价-2价变化为0价,H2S做还原剂,+4价变化为0价,二氧化硫做氧化剂,则该反应的氧化剂与还原剂的物质的量之比为1:2,所以该反应的氧化产物与还原产物的质量之比为2:1。

练习册系列答案
相关题目