题目内容
氯气是一种重要的工业原料.试回答下列相关问题:

(1)实验室可用二氧化锰和浓盐酸反应制取氯气,此反应的化学方程式是
(2)资料显示:Ca(ClO)2+CaCl2+2H2SO4
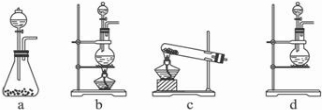
2CaSO4+2Cl2↑+2H2O.某学习小组利用此原理设计如图所示的装置制取氯气并探究其性质.
①在该实验中,甲部分的装置是
②乙装置中FeCl2溶液与Cl2反应的离子方程式是

(1)实验室可用二氧化锰和浓盐酸反应制取氯气,此反应的化学方程式是
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||
(2)资料显示:Ca(ClO)2+CaCl2+2H2SO4
| ||
①在该实验中,甲部分的装置是
c
c
(填装置字母).②乙装置中FeCl2溶液与Cl2反应的离子方程式是
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
,证明.分析:(1)依据实验室可用二氧化锰和浓盐酸反应制取氯气,书写化学方程式;
(2)①依据Ca(ClO)2+CaCl2+2H2SO4
2CaSO4+2Cl2↑+2H2O,反应是固体和液体加热制气体的制备实验需要选择c;
②氯气和氯化亚铁反应生成氯化铁.
(2)①依据Ca(ClO)2+CaCl2+2H2SO4
| ||
②氯气和氯化亚铁反应生成氯化铁.
解答:解:(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)①Ca(ClO)2+CaCl2+2H2SO4
2CaSO4+2Cl2↑+2H2O,反应是固体和液体加热制气体的制备实验需要选择c装置进行制备,a无加热,c大试管无法加入硫酸反应,
故答案为:c;
②氯气和氯化亚铁反应生成氯化铁,FeCl2溶液与Cl2反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-.
| ||
故答案为:MnO2+4HCl(浓)
| ||
(2)①Ca(ClO)2+CaCl2+2H2SO4
| ||
故答案为:c;
②氯气和氯化亚铁反应生成氯化铁,FeCl2溶液与Cl2反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-.
点评:本题考查了实验室制备氯气的装置分析和原理判断,氯气性质的应用,题目较简单.

练习册系列答案
相关题目
氯气是一种重要的工业原料.工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气.下列说法错误的是( )
| A、若管道漏气遇氨就会产生白烟 | B、该反应利用了Cl2的强氧化性 | C、该反应属于复分解反应 | D、生成1molN2有3mol电子转移 |
氯气是一种重要的工业原料.工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气.下列说法错误的是( )
| A、若管道漏气遇氨就会产生白烟 | B、该反应利用了Cl2的强氧化性 | C、该反应属于置换反应 | D、生成1mol N2有12mol电子转移 |