题目内容
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂。有关资料为:
①CuCl为微溶于水的白色固体,在空气中可被迅速氧化
②CuOH为难溶于水的黄色固体,易分解为红色的Cu2O
③Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化为蓝色
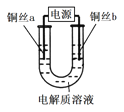
I. 甲小组同学用如下装置电解食盐水,并对电解产物进行研究。
实验装置 | 电解质溶液 | 实验现象 | |
| 5mol/L NaCl溶液 | a极附近 | b极附近 |
开始时,产生白色浑浊并逐渐增加,当沉入U型管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
(1)若a极附近生成的白色浑浊是CuCl,则铜丝a应与电源的________极相连,铜丝a的电极反应式是____。
(2)b极附近溶液的pH_________(填“增大”、“减小”或“不变”)。
(3)橙黄色沉淀中含有Cu2O,则CuCl转化为Cu2O的原因是_____________(用方程式表示)。
(4)a极附近沉淀自下而上变为橙黄色原因是____________。
II. 乙小组同学通过以下方案制取CuCl并对其组成进行研究。
将Na2SO3的水溶液逐滴加入CuCl2的水溶液中,再加入少量浓盐酸调节到pH=3左右,即可得到白色沉淀CuCl。
(1)写出产生CuCl的离子方程式______________。
(2)为了提高CuCl的产率,可采用________法快速过滤,生产过程中调节溶液的pH不能过大的原因是___。
(3)为探究白色沉淀的化学组成,将制得的白色沉淀溶于浓氨水,得到无色溶液,将无色溶液分成两份,一份放置于空气中,一段时间后溶液变为蓝色;另一份的实验方法及现象为_____________。
【答案】正Cu+Cl――e-=CuCl增大CuCl+OH-=CuOH+Cl- 、 2CuOH=Cu2O+H2O通电时,在阴极产生的OH-自下而上向阳极定向移动2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+抽滤或减压过滤防止CuCl的水解加入足量的稀硝酸,再滴加几滴硝酸银溶液,有白色沉淀生成
【解析】试题分析:本题为化学综合实验题。考查物质的制备和检验,化学实验基本操作,化学实验方案的分析、评价和设计等,题目难度中等。
I. (1)分析电解装置和信息知a极铜丝转化为CuCl,铜元素的化合价由0价升高到+1价。,发生氧化反应,作电解池的阳极,则铜丝a应与电源的正极相连,的电极反应式是Cu+Cl――e-=CuCl 。
(2)b极为电解池的阴极,电极反应式为2H2O+2e-==2OH-+H2,阴极附近溶液的pH增大。
(3)CuCl转化为Cu2O的原因是CuCl+OH-=CuOH+Cl- 、 2CuOH=Cu2O+H2O 。
(4)a极附近沉淀自下而上变为橙黄色原因是通电时,在阴极产生的OH-自下而上向阳极定向移动,CuCl与OH-反应生成CuOH,进一步分解生成Cu2O。
II. (1)根据题给信息知Na2SO3的水溶液与CuCl2的水溶液在酸性条件下发生反应,CuCl2被还原生成CuCl,则Na2SO3被氧化为Na2SO4,利用化合价升降法配平,该反应的离子方程式为2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+。
(2)为了提高CuCl的产率,可采用抽滤或减压过滤法快速过滤,生产过程中调节溶液的pH不能过大的原因是防止CuCl的水解。
(3)为探究白色沉淀的化学组成,即检验Cu+和Cl-的存在。结合题给信息设计实验方案为将制得的白色沉淀溶于浓氨水,得到无色溶液,将无色溶液分成两份,一份放置于空气中,一段时间后溶液变为蓝色;另一份的实验方法及现象为加入足量的稀硝酸,再滴加几滴硝酸银溶液,有白色沉淀生成。

【题目】除去下列物质中的杂质(括号内的物质),所使用的试剂和主要操作都正确的是
选项 | 物质 | 使用的试剂 | 主要操作 |
A | 乙醇(水) | 金属钠 | 蒸馏 |
B | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
C | 苯(苯酚) | 浓溴水 | 过滤 |
D | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
A. A B. B C. C D. D