题目内容
【题目】钛、铁、镓、砷的单质及其化合物在生产生活中有重要的应用。回答下列问题;
(1)写出As的基态原子的电子排布式_________________________。
(2)N、P、As为同一主族元素,其电负性由大到小的顺序为_________________________,它们的氢化物沸点最高的是___________,原因为____________________________。
(3)Fe3+、Co3+与N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为_________________。
②[Co(N3) (NH3)5]SO4中Co的配位数为________________,其配离子中含有的化学键类型为______(填离子键、共价键、配位键),C、N、O的第一电离能最大的为_______________,其原因是__________________________。
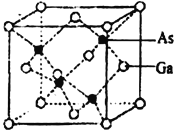
(4)砷化镓晶胞结构如下图。晶胞中Ga与周围等距且最近的As形成的空间构型为_____________。已知砷化镓晶胞边长为apm,其密度为ρg·cm-3,则阿伏加德罗常数的数值为_______(列出计算式即可)。
【答案】 [Ar] 3d104s24p3 N〉P〉As NH3 分子间能形成氢键 sp 6 共价键、配位键 N 氮原子2p轨道上的电子为半充满,相对稳定,更不易失去电子 正四面体 ![]()
【解析】(1)本题考查电子排布式的书写,As位于第四周期VA族,其电子排布式为[Ar] 3d104s24p3 ;(2)本题考查电负性以及物质熔沸点高低的判断,同主族从上到下,电负性减弱,即电负性强弱顺序是N>P>As;氨气分子间存在分子间氢键,因此NH3的熔沸点最高;(3)本题考查杂化类型的判断、化学键的判断、第一电离能规律,①C和N之间共用叁键,1molC有2个σ键,无孤电子对,因此杂化类型为sp;②N3和NH3是配位体,因此Co的配位数为1+5=6,配离子含有化学键是共价键和配位键,同周期从左向右第一电离能逐渐增大,但IIA>IA,VA>VIA,即第一电离能大小顺序是N>O>C,氮原子2p轨道上的电子为半充满,相对稳定,更不易失去电子;(4)本题考查空间构型和阿伏加德罗常数的计算,Ga到最近As的距离是相等的,因此Ga与周围等距且最近的As形成的空间构型为正四面体,晶胞的边长为apm,则晶胞的体积为(a×10-10)3cm3,Ga位于顶点和面心,个数为8×1/8+6×1/2=4,As位于晶胞内部,个数为4个,化学式为GaAs,晶胞的质量为![]() ,根据密度的定义,解得NA=
,根据密度的定义,解得NA=![]() 。
。

【题目】根据下列实验操作和现象所得结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 用玻璃棒蘸取某溶液进行焰色反应实验,火焰呈黄色 | 溶液中含有Na+ |
B | 向浓度均为0.1 mol·L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀。 | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
C | 室温下,用pH试纸测得:0.1 mol·L-1Na2CO3溶液的pH约为11;0.1 mol·L-1NaHCO3溶液的pH约为8。 | HCO3-结合H+的能力比CO32-的强 |
D | 用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别清洗做完银镜反应的试管,FeCl3溶液清洗得干净 | 存在可逆过程: Fe3++Ag |
A. A B. B C. C D. D