题目内容
将100mL 0.6 mol/L氯化铝溶液跟1mol/L氢氧化钠溶液混合后,得到3.9g Al(OH)3 沉淀,此时消耗氢氧化钠溶液的体积是
| A.130mL | B.180mL | C.190mL | D.240mL |
C
试题分析:氯化铝的物质的量=0.1L×0.6mol/L=0.06mol
最终生成的氢氧化铝的质量是3.9g,物质的量=
 =0.05mol<0.06mol
=0.05mol<0.06mol这说明反应中铝元素没有完全转化为氢氧化铝沉淀,如果氯化铝过量,则根据方程式可知:
Al3+ + 3OH-=Al(OH)3↓
1mol 3mol 1mol
0.05mol 0.15mol 0.05mol
所以消耗氢氧化钠溶液的体积=
 =0.15L=150ml
=0.15L=150ml如果反应中氯元素部分转化为AlO2-,则根据方程式可知
Al3+ + 3OH-=Al(OH)3↓
1mol 3mol 1mol
0.06mol 0.18mol 0.06mol
其中又被氢氧化钠溶液溶解的氢氧化铝是0.06mol-0.05mol=0.01mol
Al(OH)3 + OH-=AlO2-+2H2O
1mol 1mol
0.01mol 0.01mol
则最终消耗氢氧化钠的物质的量是0.18mol+0.01mol=0.19mol
因此消耗氢氧化钠溶液的体积=
 =0.19L=190ml,所以答案选C。
=0.19L=190ml,所以答案选C。
练习册系列答案
 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
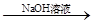 测定剩余固体质量,实验中发生反应的化学方程式是_________________________。
测定剩余固体质量,实验中发生反应的化学方程式是_________________________。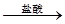 测定生成气体的体积实验装置:
测定生成气体的体积实验装置: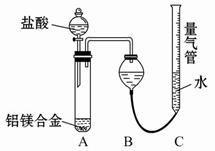



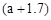 g。下列说法不正确的是
g。下列说法不正确的是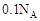
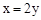
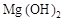 和
和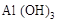 的混合物
的混合物