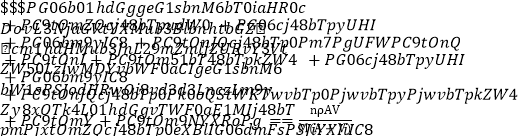题目内容
【题目】短周期元素A、B、C、D,原子序数依次增大,A的基态原子的L层电子是K层电子的两倍;B的价电子层中的未成对电子有3个;C与B同族;D的最高价含氧酸为酸性最强的无机含氧酸。请回答下列问题:
(1)C的基态原子的电子排布式为___________;D的最高价含氧酸酸性比其低两价的含氧酸酸性强的原因是_____________________________________________。
(2)杂化轨道分为等性和不等性杂化,不等性杂化时在杂化轨道中有不参加成键的孤电子对的存在。A、B、C都分别能与D形成中心原子杂化方式均为___________的共价化合物X、Y、Z。其中,属于不等性杂化的是___________ (写化学式)。
(3)比较Y、Z的熔沸点Y______Z(填“>”、“<”或“=”),并解释理由_____________________。
(4)D元素能与Cu形成棕黄色固体,加水溶解并稀释过程中,溶液颜色由绿色逐渐转化为蓝色,显绿色离子是_________________,显蓝色离子中的配位原子________________。
(5)A和B能形成多种结构的晶体。其中一种类似石墨的结构,其结构如下图所示(图1为晶体结构,图2为切片层状结构),其化学式为__________。实验测得此晶体结构属于六方晶系,晶胞结构见图3。已知图示原子都包含在晶胞内,晶胞参数a=0.64nm,c=0.24nm。其晶体密度为__________g/cm3(已知:2=1.414,后=1.732,结果精确到小数点后第2位。)

【答案】 1s22s22p63s23p3 高氯酸中非羟基氧原子为3个,氯酸中为2个或高氯酸中Cl元素为+7价,吸引羟基氧原子的能力很强,而氯酸Cl元素为+5价对羟基氧原子吸引能力较弱 sp3杂化 NCl3、PCl3 < NCl3、PCl3均为分子晶体,均无氢键,对分子质量PCl3大,熔沸点高 [CuCl4]2- O C3N4 3.59
【解析】A的基态原子的L层电子是K层电子的两倍,A为C,B的价电子层中的未成对电子有3个,则B处于ⅤA族,C与B同族,B为N,C为P,D的最高价含氧酸为酸性最强的无机含氧酸,则D为Cl。综上所述,A为C,B为N,C为P,D为Cl。
(1)C为P,其基态原子的电子排布式为![]() ;D为Cl,含氧酸中非羟基氧数目越多,中心元素化合价越高,酸性越强,高氯酸中非羟基氧原子为3个,氯酸中为2个或高氯酸中Cl元素为+7价,吸引羟基氧原子的能力很强,而氯酸中Cl元素为+5价,对羟基氧原子吸引能力较弱;正确答案:1s22s22p63s23p3 ;高氯酸中非羟基氧原子为3个,氯酸中为2个或高氯酸中Cl元素为+7价,吸引羟基氧原子的能力很强,而氯酸Cl元素为+5价对羟基氧原子吸引能力较弱。
;D为Cl,含氧酸中非羟基氧数目越多,中心元素化合价越高,酸性越强,高氯酸中非羟基氧原子为3个,氯酸中为2个或高氯酸中Cl元素为+7价,吸引羟基氧原子的能力很强,而氯酸中Cl元素为+5价,对羟基氧原子吸引能力较弱;正确答案:1s22s22p63s23p3 ;高氯酸中非羟基氧原子为3个,氯酸中为2个或高氯酸中Cl元素为+7价,吸引羟基氧原子的能力很强,而氯酸Cl元素为+5价对羟基氧原子吸引能力较弱。
(2)杂化轨道分为等性和不等性杂化,不等性杂化时在杂化轨道中有不参加成键的孤电子对的存在。C、N、P均可与Cl形成CCl4、NCl3 、PCl3,中心原子轨道杂化方式均为![]() 杂化,其中NCl3、PCl3均含有孤电子对,属于不等性杂化;正确答案:sp3杂化;NCl3、PCl3。
杂化,其中NCl3、PCl3均含有孤电子对,属于不等性杂化;正确答案:sp3杂化;NCl3、PCl3。
(3)NCl3、PCl3均为分子晶体,均无氢键;结构相似的分子晶体,相对分子质量越大,熔沸点越高,因此NCl3晶体的沸点小于PCl3晶体的沸点;正确答案:< ;NCl3、PCl3均为分子晶体,均无氢键,对分子质量PCl3大,熔沸点高。
4)氯元素能与Cu形成棕黄色固体氯化铜,当加水稀释时,水分子少,氯离子多,因此铜离子主要以[CuCl4]2- 存在,溶液显绿色;当水分子多,氯离子少时,铜离子主要以水合铜离子([Cu(H2O)4]2+)的形式存在,溶液显蓝色,显蓝色离子中的配位原子为O;正确答案:[CuCl4]2- ;O。
(5)C和N能形成多种结构的晶体,其中一种类似于金刚石的结构,硬度比金刚石大,属于原子晶体,图2切片层状结构中菱形内为层内重复结构单元,含有6个C原子,8个N原子,C、N数目比为3:4,故化学式为C3N4 ;实验测得此晶体结构属于六方晶系,晶胞结构所示原子都包含在晶胞内,晶胞质量为![]() ,晶胞体积为
,晶胞体积为![]() ,晶胞密度
,晶胞密度![]() ;正确答案:C3N4;3.59。
;正确答案:C3N4;3.59。

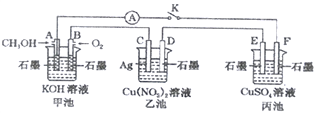
【题目】废旧电池若不进行回收利用,将对水体产生严重污染。某兴趣小组对废旧镍电池正极材料[由Ni(OH)2、碳粉、Fe2O3等涂覆在铝箔上制成]进行回收研究,设计实验流程如下图所示:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+,Cl2能氧化Ni2+为Ni3+;
②NiO+2HCl=NiCl2+H2O;
③Fe3+、Al3+、Ni3+以氢氧化物形式沉淀时溶液的pH如下表所示:
离子 | Fe3+ | Al3+ | Ni2+ |
开始沉淀时的pH | 1.5 | 3.5 | 7.0 |
完全沉淀时的pH | 3.2 | 4.8 | 9.0 |
④Ksp[Ni(OH)2]=5.0×10-16,Ksp(NiC2O4)=4.0×10-10。
请回答下列问题:
(1)酸溶后所留残渣的主要成份__________(填物质名称)。
(2)步骤X的操作为用NiO调节溶液pH,首先析出的沉淀Ⅰ是__________(填化学式),调节过程中pH不能低于___________。
(3)已知溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O,则加入Na2C2O4溶液后析出的沉淀是__________。
(4)写出生成沉淀Ⅲ的离子方程式__________,该反应的平衡常数为__________。
(5)用化学反应方程式表示沉淀Ⅲ转化为Ni(OH)3________________________。
(6)过滤③后如何检验Ni(OH)3已洗涤干净____________________________。