题目内容
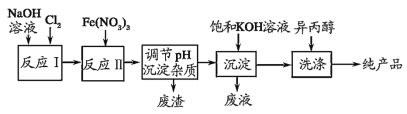
【题目】高铁酸钾(K2FeO4)是一种集氧化、杀菌、脱色、除臭的新型高效水处理剂,工业上可通过 Fe(NO3)3 与NaClO在强碱性介质中反应生成紫红色高铁酸盐溶液,其对应的工业流程如图所示。有关说法正确的是( )
A.K2FeO4能够作为净水剂的原因,在于其氧化产物能够水解生成氢氧化铁胶体
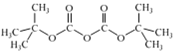
B.反应II的离子方程式为 3ClO+5H2O+2Fe3+=2![]() +3Cl+10H+
+3Cl+10H+
C.向Na2FeO4 中加入饱和KOH 溶液,析出K2FeO4 沉淀,说明K2FeO4 的溶解度比Na2FeO4 大
D.洗涤粗品时选用异丙醇而不用水,可以减少K2FeO4的溶解损失
【答案】D
【解析】
反应Ⅰ:2NaOH+Cl2=NaCl+NaClO+H2O,反应Ⅱ:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,调节pH沉淀杂质,得到Na2FeO4溶液,加入饱和KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4,反应方程式为Na2FeO4+2KOH=K2FeO4+2NaOH,过滤,高铁酸钾易溶于水,难溶于异丙醇,用异丙醇代替水洗涤产品可以减少高铁酸钾的损耗,同时洗去高铁酸钾晶体表面的KOH和其它杂质,得到纯产品高铁酸钾。
A. 高铁酸钾( K2FeO4)中Fe元素的化合价是+6价,具有强氧化性,能杀菌消毒,其还原产物Fe3+水解生成氢氧化铁胶体,吸附水中杂质,作净水剂,A错误;
B. 反应II是Fe(NO3)3与NaClO在强碱性介质中反应生成高铁酸盐的反应,离子方程式为:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,B错误;
C. 向Na2FeO4中加入饱和KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4,C错误;
D. 高铁酸钾易溶于水,难溶于异丙醇,用异丙醇代替水洗涤产品可以减少高铁酸钾的损耗,同时洗去高铁酸钾晶体表面的KOH和其它杂质,得到纯产品高铁酸钾,D正确;
故答案为:D。