题目内容
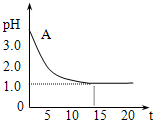 电解氯化铜溶液时,实验测得其溶液的pH变化如图所示.下列有关说法中不正确的是( )
电解氯化铜溶液时,实验测得其溶液的pH变化如图所示.下列有关说法中不正确的是( )分析:A、根据离子的放电顺序判断电池反应式;
B、根据氢离子浓度与溶液PH值的关系分析;
C、根据铜离子浓度的变化对水电离产生的氢离子的影响分析;
D、根据氯气的性质分析;
B、根据氢离子浓度与溶液PH值的关系分析;
C、根据铜离子浓度的变化对水电离产生的氢离子的影响分析;
D、根据氯气的性质分析;
解答:解:A、电解氯化铜溶液时,溶液中的铜离子和氯离子放电析出铜和氯气,所以电池反应式为CuCl2
Cu+Cl2↑,故A正确.
B、根据图象分析知,在电解过程中,溶液的PH值逐渐减小最后趋向于恒值,所以溶液中H+浓度逐渐增大最后趋向于恒定值,故B错误.
C、随着电解的进行,溶液中Cu2+浓度逐渐减小,水解平衡向逆反应方向移动,所以由Cu2+水解产生的H+越来越少,故C正确.
D、电解时阳极上产生的氯气能溶于水,生成HClO和HCl,酸电离出氢离子,使氢离子浓度增大,pH变小,故D正确.
故选B.
| ||
B、根据图象分析知,在电解过程中,溶液的PH值逐渐减小最后趋向于恒值,所以溶液中H+浓度逐渐增大最后趋向于恒定值,故B错误.
C、随着电解的进行,溶液中Cu2+浓度逐渐减小,水解平衡向逆反应方向移动,所以由Cu2+水解产生的H+越来越少,故C正确.
D、电解时阳极上产生的氯气能溶于水,生成HClO和HCl,酸电离出氢离子,使氢离子浓度增大,pH变小,故D正确.
故选B.
点评:本题考查了有关电解原理的问题,电解时只有明确溶液中的离子放电顺序才能正确书写电极反应式,电解氯化铜溶液时知道为什么溶液的PH值减小而不是增大,不仅考虑电解问题还有考虑生成物的溶解性,只有明确这些问题才能正确解答.

练习册系列答案
相关题目
某校化学小组的同学进行以碳棒为电极电解氯化铜溶液时发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出.为探究阴极碳棒上的产物,设计了如下过程:
Ⅰ、有关资料
铜的化合物颜色性质如下:
Ⅱ、探究实验
(1)提出假设:
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为CuCl.
(2)实验验证:
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物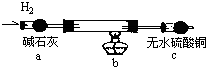
实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色.
①碳棒上的红色物质是否有Cu2O (填“是”或“否”),理由是 ;
②在c装置后将气体通入 中,若出现白色沉淀,可说明提出假设②中的白色物质一定存在;
③写出装置b中发生反应的化学方程式: .
(3)问题讨论:
①电解CuCl2溶液后的阴极上发生的反应为:Cu2++2e-=Cu和 ;
②用石墨电极电解饱和硫酸铜溶液,观察阴极碳棒表面出现的现象红色物质附着,无白色物质,加入 后继续电解,出现白色物质.
Ⅰ、有关资料
铜的化合物颜色性质如下:
| 物质 | 颜色、性质 | 物质 | 颜色、性质 |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
| 氧化亚铜(CuO) | 红色固体不溶于水 | 氯化铜(CuCl2) | 溶液呈绿色,稀溶液呈蓝色 |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
(1)提出假设:
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为CuCl.
(2)实验验证:
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物

实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色.
①碳棒上的红色物质是否有Cu2O
②在c装置后将气体通入
③写出装置b中发生反应的化学方程式:
(3)问题讨论:
①电解CuCl2溶液后的阴极上发生的反应为:Cu2++2e-=Cu和
②用石墨电极电解饱和硫酸铜溶液,观察阴极碳棒表面出现的现象红色物质附着,无白色物质,加入
 关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:观点一是:“理论派”认为电解氯化铜溶液后溶液的pH升高.观点二是:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH的变化如图曲线的关系.?请回答下列问题:
关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:观点一是:“理论派”认为电解氯化铜溶液后溶液的pH升高.观点二是:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH的变化如图曲线的关系.?请回答下列问题: 电解氯化铜溶液时,实验测得其溶液的pH随时间的变化如图所示,下列有关说法不正确的是( )
电解氯化铜溶液时,实验测得其溶液的pH随时间的变化如图所示,下列有关说法不正确的是( ) A.电解氯化铜溶液的方程式为:
A.电解氯化铜溶液的方程式为: