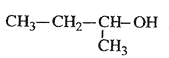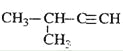题目内容
【题目】如图是一种综合处理SO2废气的工艺流程。下列说法正确的是( )

A.向B溶液中滴加KSCN溶液,溶液可能变为红色
B.溶液B转化为溶液C发生反应的离子方程式为4H++2Fe2++O2=2Fe3++2H2O
C.溶液酸性:A>B
D.加氧化亚铁可以使溶液C转化为溶液A
【答案】A
【解析】
A.铁离子和二氧化硫反应生成亚铁离子和硫酸根,可能铁离子过量,因此向B溶液中滴加KSCN溶液,溶液可能变为红色,A正确;
B.溶液B转化为溶液C发生反应的离子方程式为4H++4Fe2++O2=4Fe3++2H2O,B错误;
C.溶液A发生的离子方程式为2Fe3++2H2O+SO2=2Fe2++4H++SO42,因此溶液酸性:B>A,C错误;
D.加氧化亚铁与酸反应不能生成Fe3+,D错误。
答案为A。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如下:
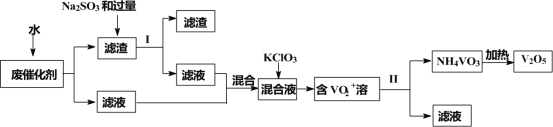
已知:①部分含钒物质常温下在水中的溶解性如表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
②VO2++2OH-![]() VO3-+H2O
VO3-+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为____________(写一条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为____________(填离子符号)。
(3)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式为____________。
(4)生成VO2+的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式为____________。
(5)在第Ⅱ步中需要加入氨水,请结合化学用语,用平衡移动原理解释加入氨水的一种作用为____________。
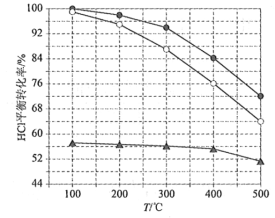
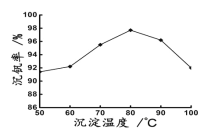
(6)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。请结合如图解释在第Ⅱ步中温度超过80°C以后,沉钒率下降的可能原因是____________;____________(写两条)。
(7)该工艺流程中可以循环利用的物质为____________。
(8)测定产品中V2O5的纯度:
称取ag产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1mLc1mol·L1(NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+==VO2++Fe3++H2O)。最后用c2mol·L1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO4-被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182g·mol1)的质量分数是____________。(列出计算式)
【题目】实验室制备 1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
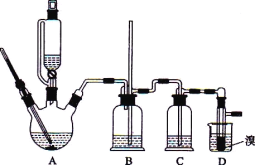
可能存在的主要副反应有:乙醇在浓硫酸的存在下在 l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备 1,2-二溴乙烷的装置如下图所示:
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到 170℃ 左右,其最主要目的是_____;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入_____,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)若产物中有少量未反应的 Br2,最好用_____洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(4)判断该制各反应已经结束的最简单方法是_____;
(5)若产物中有少量副产物乙醚,可用_____的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是____;但又不能过度冷却(如用冰水),其原因是_____