��Ŀ����
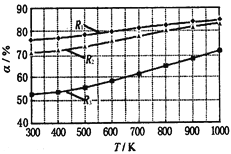
����Ŀ��̼�������(CH3OCOOC2H5)��һ�������﮵���л����Һ������̼���������ԭ��Ϊ��C2H5OCOOC2H5(g)+ CH3OCOOCH3(g)![]() 2 CH3OCOOC2H5(g)������������ͬ��CH3OCOOCH3��ƽ��ת����(��)���¶�(T)����Ӧ����ȣ�R=n(C2H5OCOOC2H5):n(CH3OCOOCH3)���Ĺ�ϵ����ͼ��ʾ�����ַ�Ӧ����ȷֱ�Ϊ1:1��2:1��3:1������˵������ȷ����( )
2 CH3OCOOC2H5(g)������������ͬ��CH3OCOOCH3��ƽ��ת����(��)���¶�(T)����Ӧ����ȣ�R=n(C2H5OCOOC2H5):n(CH3OCOOCH3)���Ĺ�ϵ����ͼ��ʾ�����ַ�Ӧ����ȷֱ�Ϊ1:1��2:1��3:1������˵������ȷ����( )
A.�÷�Ӧ��H �� 0
B.R1��Ӧ�ķ�Ӧ�����Ϊ3:1
C.650������Ӧ�����Ϊ1:1ʱ��ƽ�ⳣ��K = 6
D.�÷�ӦΪȡ����Ӧ
���𰸡�C
��������
A���������������������£������¶ȣ�CH3OCOOCH3��ƽ��ת��������˵��ƽ�������ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ����ƶ�����������Ӧ���������ȷ�Ӧ���÷�Ӧ��H �� 0����ȷ��
B���÷�Ӧǰ������ķ��������䣬�������������������£�����ijһ��Ӧ��ı������������������Ӧ���ת���ʣ�����������ת���ʷ������͡����Կ�����Ӧ����C2H5OCOOC2H5��Ũ�ȣ�������������CH3OCOOCH3��ƽ��ת���ʡ�����R1��ת������ߣ�����R1��Ӧ�ķ�Ӧ�����Ϊ3:1����ȷ��
C��650������Ӧ�����Ϊ1:1ʱ��CH3OCOOCH3��ƽ��ת������Ϊ60�������������ݻ�ΪVL����ʼʱ�����ʵ�Ũ��Ϊ��C(C2H5OCOOC2H5)=1/V�� C(CH3OCOOCH3)=1/V�� C(CH3OCOOC2H5)=0����ƽ��ʱC(C2H5OCOOC2H5)=0.4/V�� C(CH3OCOOCH3)=0.4/V�� C(CH3OCOOC2H5)=1.2/V��K��(1.2/V)2/��0.4/V��2=9������
D���ɷ�Ӧ����ʽ�ɿ����÷�ӦΪȡ����Ӧ����ȷ��
��ѡC��

����Ŀ�����ΪԪ�����ڱ���һ���֣������Ԫ�آ٣����ڱ��е�λ�ã��û�ѧ����ش��������⣺
�� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
1 | �� | |||||||
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� |
��1���ܡ���Ԫ�ط��ŷֱ���_____��______
��2����Ԫ���⻯��ĵ���ʽ��________
��3����Ԫ�ص�ԭ�ӽṹʾ��ͼ��__________
��4��Ԫ�آ٣�����ԭ�Ӱ뾶������_____��
��6����ʢ��ˮ��С�ձ��м���Ԫ�آݵĵ��ʣ�������Ӧ�����ӷ���ʽΪ______����������Ӧ�����Һ�м���Ԫ�آĵ��ʣ�������Ӧ�Ļ�ѧ����ʽΪ______��


