题目内容
下列各组离子中,在碱性溶液中共存,在加入盐酸过程中会产生气体和沉淀的是( )A.Na+、NO3-、A13+、SO42-
B.K+、NO3-、Na+、SiO32-
C.Na+、Br-、A1O2-、S2-
D.SO42-、HCO3-、Ca2+、NH4+
【答案】分析:在碱性溶液中离子不能结合生成水、气体、沉淀、弱电解质等,则离子能共存,然后结合加入盐酸过程中会产生气体和沉淀来解答.
解答:解:A.碱性溶液中,A13+、OH-结合生成沉淀,则不能共存,故A不选;
B.碱性溶液中该组离子之间不反应,能共存,但加入酸氢离子与SiO32-结合生成硅酸沉淀,不符合题意,故B不选;
C.溶液中该组离子之间不反应,能共存,且加入酸,氢离子与A1O2-结合生成沉淀,与S2-结合生成气体,符合题意,故C选;
D.因碱性溶液中HCO3-、OH-能发生反应,SO42-、Ca2+结合生成沉淀,NH4+、OH-能结合生成弱电解质,则不能共存,故D不选;
故选C.
点评:本题考查离子的共存,明确离子之间的反应是解答本题的关键,并注意题目中的限制条件来解答,题目难度不大.
解答:解:A.碱性溶液中,A13+、OH-结合生成沉淀,则不能共存,故A不选;
B.碱性溶液中该组离子之间不反应,能共存,但加入酸氢离子与SiO32-结合生成硅酸沉淀,不符合题意,故B不选;
C.溶液中该组离子之间不反应,能共存,且加入酸,氢离子与A1O2-结合生成沉淀,与S2-结合生成气体,符合题意,故C选;
D.因碱性溶液中HCO3-、OH-能发生反应,SO42-、Ca2+结合生成沉淀,NH4+、OH-能结合生成弱电解质,则不能共存,故D不选;
故选C.
点评:本题考查离子的共存,明确离子之间的反应是解答本题的关键,并注意题目中的限制条件来解答,题目难度不大.

练习册系列答案
相关题目
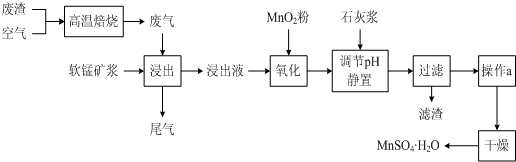
为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体的生产流程,其流程示意图如下:

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
请回答下列问题:
(1)写出浸出过程中主要反应的化学方程式:______.
(2)写出氧化过程中主要反应的离子方程式:______.
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至______.
(4)滤渣的主要成分有______.
(5)下列各组试剂中,能准确测定尾气中SO2含量的是______.(填编号)
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液 c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)已知废气中SO2浓度为6.4g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000m3废气,可得到硫酸锰晶体质量为______kg.

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH | 加碱溶解的pH |
| Fe2+ | 7.6 | 9.7 | |
| Fe3+ | 2.7 | 3.7 | |
| Al3+ | 3.8 | 4.7 | >8.5 |
| Mn2+ | 8.3 | 9.8 |
(1)写出浸出过程中主要反应的化学方程式:______.
(2)写出氧化过程中主要反应的离子方程式:______.
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至______.
(4)滤渣的主要成分有______.
(5)下列各组试剂中,能准确测定尾气中SO2含量的是______.(填编号)
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液 c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)已知废气中SO2浓度为6.4g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000m3废气,可得到硫酸锰晶体质量为______kg.