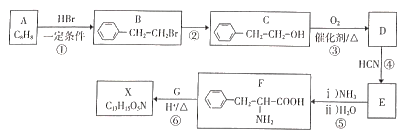
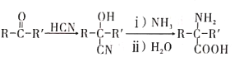题目内容
【题目】下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)]
③在0.1 mol·L1氨水中滴加0.lmol·L1盐酸,恰好完全反应时溶液的pH=a,则由水电离产生的c(OH-)=l0-amol·L-1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤浓度相等的a、NH4HSO4溶液、b、NH4HCO3溶液、c、NH4Cl溶液中的c(NH4+):a >b>c
⑥NaHSO3溶液显酸性,c(Na+)>c(HSO3-)>c(H+)>c(OH-)>c(SO32-)
⑦常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
⑧pH=3.6的0.1mol/L HX与0.1mol/L NaX的混合溶液中,c(H+)-c(OH-)=c(X-)-c(HX)
A. ②④⑥⑦ B. ②⑤⑦⑧ C. ①③⑤⑥ D. ②⑤⑥⑧
【答案】D
【解析】
①NaHCO3溶液加水稀释,促进HCO3-的水解;
②2c(Na+)=3[c(CO32-)+c(HCO3-)],不符合物料守恒关系;
③在0.1 mol·L1氨水中滴加0.lmol·L1盐酸,恰好完全反应时,生成氯化铵,铵根离子水解,促进水的电离;
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,钠离子的浓度增大,引入氢氧根离子,抑制亚硫酸根离子的水解;
⑤a、NH4HSO4溶液中H+抑制铵根离子的水解,铵根离子的浓度最大;b、NH4HCO3溶液中碳酸氢根对铵根离子的水解具有促进作用,铵根离子的浓度最小;c、NH4Cl溶液中氯离子对铵根离子的水解没有影响;
⑥NaHSO3溶液显酸性,亚硫酸氢根离子的电离大于水解;
⑦常温下,CH3COONa和CH3COOH混合溶液pH=7,c(Na+)=0.1 mol·L-1,结合电荷守恒分析判断离子难度大小;
⑧pH=3.6的0.1mol/L HX与0.1mol/L NaX的混合溶液中,HX电离程度大于X-离子水解程度。
①NaHCO3溶液加水稀释,促进HCO3-的水解,相对来说,钠离子的浓度比碳酸氢根的浓度减小的慢些,所以c(Na+)/ c(HCO3-)的比值保持增大,故①正确;
②浓度均为0.1 mol·L1的Na2CO3、NaHCO3混合溶液,根据物料守恒有:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],故②错误;
③在0.1 mol·L1氨水中滴加0.lmol·L1盐酸,恰好完全反应时,生成氯化铵,铵根离子水解,促进水的电离,溶液的pH=a,那么c(H+)=c(OH-)=l0-amol·L-1,故③正确;
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,钠离子的浓度增大,引入氢氧根离子,抑制亚硫酸根离子的水解,所以c(Na+)、c(SO32-)均增大,故④正确;
⑤浓度相等的a、NH4HSO4溶液中H+抑制铵根离子的水解,铵根离子的浓度最大;b、NH4HCO3溶液中碳酸氢根对铵根离子的水解具有促进作用,铵根离子的浓度最小;c、NH4Cl溶液中氯离子对铵根离子的水解没有影响,所以c(NH4+):①![]() ③
③![]() ②,故⑤错误;
②,故⑤错误;
⑥NaHSO3溶液显酸性,亚硫酸氢根离子的电离大于水解,因为弱电解质的电离和水解程度微弱,所以有c(Na+)>c(HSO3-)>c(H+)>c(SO32-) >c(OH-),故⑥错误;
⑦常温下,CH3COONa和CH3COOH混合溶液pH=7,c(Na+)=0.1 mol·L-1,c(Na+)=c(CH3COO-)= 0.1 mol·L-1>c(CH3COOH)>c(H+)=c(OH-)= 10-7mol·L-1,,故⑦正确;
⑧0.1mol/L HX与0.1mol/L NaX的混合溶液,根据电荷守恒有:c(H+)+c(Na+)=c(X-)+c(OH-)
,c(H+)- c(OH-)=c(X-)- c(Na+),因为HX发生电离,所以c(HX)与c(Na+)不相等,c(H+)-c(OH-)=c(X-)-c(HX)不成立,故⑧错误。
综合以上分析,②⑤⑥⑧错误。
故答案选D。