题目内容
用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。已知反应:( )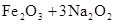

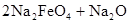 ,下列说法正确的是
,下列说法正确的是
| A.Na2O2既是氧化剂又是还原剂 |
| B.3 mol Na2O2发生反应,有12 mol电子转移 |
| C.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
| D.Na2FeO4既是氧化产物又是还原产物 |
D
解析正确答案:D
A.不正确,Na2O2是氧化剂
B.不正确,3 mol Na2O2发生反应,有6 mol电子转移,Na2O2氧由-1价降到-2价
C.不正确,在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌
D.正确,Na2FeO4既是氧化产物又是还原产物,铁元素化合价升到+6价,氧元素由-1价降到-2价。

练习册系列答案
相关题目
用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术,制取Na2FeO4的反应为:Fe2O3+3Na2O2═2Na2FeO4+Na2O,下列说法不正确的是( )
| A、Fe2O3是反应的还原剂 | B、Na2O2既是氧化剂又是还原剂 | C、Na2FeO4反应的氧化产物 | D、Na2FeO4能消毒杀菌是因其具有强氧化性 |
用高铁酸钠(Na2FeO4)对河水消毒是饮水处理的新技术,已知制取Na2FeO4的反应为:
Fe2O3+3Na2O2
2Na2FeO4+Na2O,下列说法正确的是( )
Fe2O3+3Na2O2
| ||
| A、Na2O既是氧化产物又是还原产物 |
| B、在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌 |
| C、Fe2O3既做氧化剂又做还原剂 |
| D、该反应中氧化性比较:Na2FeO4大于Na2O2 |
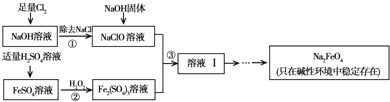
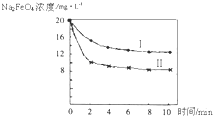 (2012?朝阳区一模)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
(2012?朝阳区一模)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下: