题目内容
用高铁酸钠(Na2FeO4)对河水消毒是饮水处理的新技术,已知制取Na2FeO4的反应为:
Fe2O3+3Na2O2
2Na2FeO4+Na2O,下列说法正确的是( )
Fe2O3+3Na2O2
| ||
| A、Na2O既是氧化产物又是还原产物 |
| B、在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌 |
| C、Fe2O3既做氧化剂又做还原剂 |
| D、该反应中氧化性比较:Na2FeO4大于Na2O2 |
分析:Fe2O3+3Na2O2
2Na2FeO4+Na2O中,Fe元素的化合价由+3价升高为+6价,O元素的化合价由-1价降低为-2价,以此来解答.
| ||
解答:解:Fe2O3+3Na2O2
2Na2FeO4+Na2O中,Fe元素的化合价由+3价升高为+6价,O元素的化合价由-1价降低为-2价,
A.Na2O是还原产物,故A错误;
B.由化合物中正负化合物的倒数和为0,Na为+1价,O为-2价,则在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌,故B正确;
C.Fe2O3做还原剂,故C错误;
D.氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,则该反应中氧化性比较:Na2FeO4小于Na2O2,故D错误;
故选B.
| ||
A.Na2O是还原产物,故A错误;
B.由化合物中正负化合物的倒数和为0,Na为+1价,O为-2价,则在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌,故B正确;
C.Fe2O3做还原剂,故C错误;
D.氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,则该反应中氧化性比较:Na2FeO4小于Na2O2,故D错误;
故选B.
点评:本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,注意具有高价金属离子具有强氧化性,题目难度不大.

练习册系列答案
相关题目
用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术,制取Na2FeO4的反应为:Fe2O3+3Na2O2═2Na2FeO4+Na2O,下列说法不正确的是( )
| A、Fe2O3是反应的还原剂 | B、Na2O2既是氧化剂又是还原剂 | C、Na2FeO4反应的氧化产物 | D、Na2FeO4能消毒杀菌是因其具有强氧化性 |
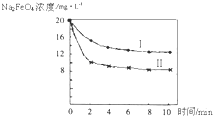 (2012?朝阳区一模)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
(2012?朝阳区一模)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下: