题目内容
酸、碱指示剂本身就是弱酸或弱碱,滴定操作时,酸(碱)首先和被滴定的碱(酸)反应,而后过量酸(碱)和指示剂作用变色,显然指示剂的酸碱性较弱.沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度比滴定剂和指示剂的生成物的溶解度______(填大、小、相同),否则不能用这种指示剂.
| AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN | |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| 溶解度mol/L | 1.34×10-5 | 7.1×10-7 | 1.1×10-8 | 7.9×10-5 | 1.0×10-6 |
A.NaCl B.BaBr2 C.NaSCN D.Na2CrO4
(2)用AgNO3溶液滴定KCl等含氯离子溶液时常用K2CrO4溶液做指示剂,锥型瓶中现有氯离子浓度约为0.1mol/L KCl溶液18.90mL,向其中加入2滴(共0.1mL)0.2mol/L的Na2CrO4溶液,然后用浓度约为0.1mol/L AgNO3溶液进行滴定.试计算达到终点时溶液中氯离子的最大浓度.
【答案】分析:只有当滴定剂和被滴定物的生成物的溶解度比滴定剂和指示剂的生成物的溶解度小时,反应能进行.
(1)完全反应后,继续滴加滴定剂,滴定剂和指示剂反应生成沉淀,保证滴定剂和被滴定物完全反应;
(2)根据溶度积常数计算.
解答:解:当滴定剂和被滴定物的生成物的溶解度比滴定剂和指示剂的生成物的溶解度小时,完全反应后,继续滴加滴定剂,滴定剂和指示剂反应生成沉淀,保证滴定剂和被滴定物完全反应,故答案为:小;
(1)若用AgNO3去滴定NaSCN溶液,可选用的滴定指示剂的物质的溶解度应比AgSCN大,且现象明显,应为Na2CrO4,混合物中有砖红色沉淀生成,
故答案为:D;混合物中有砖红色沉淀生成;
(2)由AgCl和Ag2CrO4的溶度积常数可知,要比较AgCl与Ag2CrO4的溶解度的大小,实际上是比较对应饱和溶液中阴离子浓度的大小.
由题意知Ksp(AgCl)=c(Ag+)?c(Cl-)=c2(Cl-)=1.8×10-10mol2?L-2,
Ksp(Ag2CrO4)=c2(Ag+)?c(CrO42-)=4c3(CrO4-)=1.9×10-12mol3?L-3,
AgCl的溶解度更小,加入硝酸银时先生成AgCl沉淀,所以当氯离子全部被消耗时,溶液的体积为18.90mL×2+0.1mL≈38mL,
此时c(CrO42-)= =5.26×10-4mol/L,
=5.26×10-4mol/L,
c(Ag+)=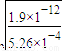 mol/L=6×10-5mol/L,
mol/L=6×10-5mol/L,
c(Cl-)=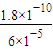 mol/L=3×10-6mol/L,
mol/L=3×10-6mol/L,
答:达到终点时溶液中氯离子的最大浓度为3×10-6mol/L.
点评:本题考查难溶电解质的溶解平衡问题,题目以信息题的形式考查,注意把握题目信息.
(1)完全反应后,继续滴加滴定剂,滴定剂和指示剂反应生成沉淀,保证滴定剂和被滴定物完全反应;
(2)根据溶度积常数计算.
解答:解:当滴定剂和被滴定物的生成物的溶解度比滴定剂和指示剂的生成物的溶解度小时,完全反应后,继续滴加滴定剂,滴定剂和指示剂反应生成沉淀,保证滴定剂和被滴定物完全反应,故答案为:小;
(1)若用AgNO3去滴定NaSCN溶液,可选用的滴定指示剂的物质的溶解度应比AgSCN大,且现象明显,应为Na2CrO4,混合物中有砖红色沉淀生成,
故答案为:D;混合物中有砖红色沉淀生成;
(2)由AgCl和Ag2CrO4的溶度积常数可知,要比较AgCl与Ag2CrO4的溶解度的大小,实际上是比较对应饱和溶液中阴离子浓度的大小.
由题意知Ksp(AgCl)=c(Ag+)?c(Cl-)=c2(Cl-)=1.8×10-10mol2?L-2,
Ksp(Ag2CrO4)=c2(Ag+)?c(CrO42-)=4c3(CrO4-)=1.9×10-12mol3?L-3,
AgCl的溶解度更小,加入硝酸银时先生成AgCl沉淀,所以当氯离子全部被消耗时,溶液的体积为18.90mL×2+0.1mL≈38mL,
此时c(CrO42-)=
 =5.26×10-4mol/L,
=5.26×10-4mol/L,c(Ag+)=
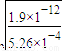 mol/L=6×10-5mol/L,
mol/L=6×10-5mol/L,c(Cl-)=
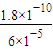 mol/L=3×10-6mol/L,
mol/L=3×10-6mol/L,答:达到终点时溶液中氯离子的最大浓度为3×10-6mol/L.
点评:本题考查难溶电解质的溶解平衡问题,题目以信息题的形式考查,注意把握题目信息.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目