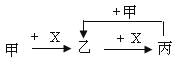
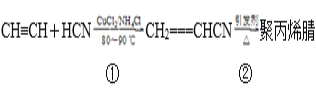
题目内容
【题目】碲是当代高科技材料不可缺少的重要组成元素。以铋碲矿(主要含Te、Bi、Si、S等元素)为原料生产精碲的工艺流程如下:

已知:TeO2是两性氧化物,微溶于水.回答下列问题:
(1)浸出液中碲以TeO2+存在,步骤①加入Na2SO3进行还原,反应的离子方程式为________。Na2SO3的实际用量比理论用量偏多,其主要原因是________。
(2)王水是由约3体积浓盐酸和约1体积浓硝酸配制而成。在实验室中配制王水所用的玻璃仪器除玻璃棒外还有________。王水溶解粗碲时,加入的碲粉与生成的NO的物质的量之比为________。
(3)粗碲中仍含有硅元素,净化时加入CaCl2溶液可以除去硅元素,硅元素将以________(填化学式)形式被除去。
(4)步骤③,将Na2TeO3转化为TeO2,反应的离子方程式是________。
(5)电解时,精碲在______极析出,电解产物中可循环使用的是________。
【答案】TeO2++2SO32-+H2O=Te↓+2SO42-+2H+ Na2SO3与盐酸反应产生SO2 (或与浸出液中其他氧化性物质反应) 量筒和烧杯 3:4 CaSiO3 TeO32-+2H+=TeO2↓+H2O 阴 NaOH
【解析】
(1) 碲以TeO2+存在,步骤①加入Na2SO3进行还原,发生氧化还原反应生成粗碲、硫酸根离子,并用电荷守恒配平;浸泡时,用HCl、NaClO3过量,加入亚硫酸钠时会发生化学反应;
(2) 实验室配制王水时,量取盐酸、硝酸的体积用量筒,配制时在烧杯中,搅拌使用玻璃棒;王水溶解粗碲时,反应的离子方程式为3Te+4H++4NO3-=3TeO2+4NO↑+2 H2O;
(3)粗碲中仍含有硅元素,且以硅酸根离子的形式存在;
(4)步骤③,通过调节pH,将Na2TeO3转化为TeO2;
(5) TeO2是两性氧化物,加入NaOH时,以TeO32-形式存在,电解时,Te的化合价降低,得电子生成氢氧根离子、Te。
(1) 碲以TeO2+存在,步骤①加入Na2SO3进行还原,发生氧化还原反应生成粗碲、硫酸根离子,并用电荷守恒配平,离子方程式为TeO2++2SO32-+H2O=Te↓+2SO42-+2H+;浸泡时,用HCl、NaClO3过量,加入亚硫酸钠时会发生化学反应,导致Na2SO3的实际用量比理论用量偏多;
(2) 实验室配制王水时,量取盐酸、硝酸的体积用量筒,配制时在烧杯中,搅拌使用玻璃棒;王水溶解粗碲时,反应的离子方程式为3Te+4H++4NO3-=3TeO2+4NO↑+2 H2O,碲粉与生成的NO的物质的量之比为3:4;
(3)粗碲中仍含有硅元素,且以硅酸根离子的形式存在,加入CaCl2溶液时可生成硅酸钙沉淀;
(4)步骤③,通过调节pH,将Na2TeO3转化为TeO2,反应的离子方程式为TeO32-+2H+=TeO2↓+H2O;
(5) TeO2是两性氧化物,加入NaOH时,以TeO32-形式存在,电解时,Te的化合价降低,得电子,则在阴极产生;同时生成氢氧根离子,则可循环使用物质为NaOH。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案