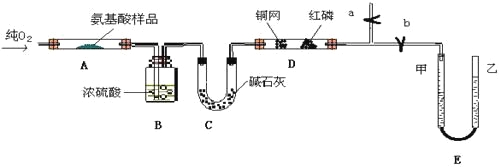
��Ŀ����
����Ŀ����100 mL NaOH��Һ��ͨ��һ������CO2���壬��ַ�Ӧ������������Һ����μ���0.2 mol/L�����ᣬ����CO2������������������֮���ϵ��ͼ��ʾ��������CO2���ܽ⣩�������ж���ȷ����
A.ԭNaOH��Һ��Ũ��Ϊ0.2 mol/L
B.ͨ��CO2�ڵ����Ϊ336 mL
C.������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaOH)��n(Na2CO3)��1��3
D.������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaHCO3)��n(Na2CO3)��1��1
���𰸡�A
��������
����CO2�����ķ�ӦΪ��NaHCO3+HCl=NaCl+CO2��+H2O������NaOH��CO2���巴Ӧ������Һ��ֻ��Na2CO3����ʼ�η�����Ӧ��Na2CO3+HCl=NaHCO3+NaCl���ɷ���ʽ��֪��ǰ��������������������Ӧ��ȣ���ʵ�����ɶ�����̼���ĵ���������࣬��NaOH��CO2���巴Ӧ������Һ������ΪNa2CO3��NaHCO3��
A. ����ͼ����100mL����ʱ����Ϊ�Ȼ��ơ�������̼��ˮ�������غ��ϵ�ó�n(HCl) =n(NaOH) = 0.2mol/L��0.1L =0.02mol��ԭNaOH��Һ��Ũ��![]() ����A��ȷ��
����A��ȷ��
B.����ͼ���֪NaHCO3 + HCl = NaCl + H2O + CO2�������ɶ�����̼�����ʵ���������������ʵ��������n(CO2) = 0.2mol/L��(0.1-0.025)L = 0.015mol�����ͨ��CO2���ڷ�Ӧ���ɵĶ�����̼������״���µ����Ϊ0.015mol ��22.4L/mol = 336 mL����������û��˵���Ƿ��DZ�״���£�������CO2������������B����
C.Na2CO3ת��ΪNaHCO3��������Ϊ25mL������NaHCO3ת��Ϊ������̼�ֿ�����������25mL����NaOH��CO2���巴Ӧ������Һ��NaHCO3��������������Ϊ75mL-25mL=50mL����Na2CO3��NaHCO3�����ʵ���֮��Ϊ25mL��50mL=1��2��ԭ��Һ�в�����NaOH����C����
D����C�з�����֪��Na2CO3��NaHCO3�����ʵ���֮��Ϊ25mL��50mL=1��2����D����
������������ΪA��

 ���100��1�ž�ϵ�д�
���100��1�ž�ϵ�д�����Ŀ����һ��������ܱ������У��������»�ѧ��Ӧ��
CO2��g����H2��g��![]() CO��g����H2O��g����
CO��g����H2O��g����
�仯ѧƽ�ⳣ��K ���¶�t�Ĺ�ϵ���±���
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
(1)�÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK ��_____________________��
(2)�÷�ӦΪ____________��Ӧ��ѡ����ȡ��������ȡ�����
(3)���жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬��������_____________��
a��������ѹǿ���� b����������� c��CO������
c��������H2����������H2O�� d��c��CO2����c��CO��
(4)ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2����c��H2����c��CO����c��H2O�������жϴ�ʱ���¶�Ϊ _________��
(5)1200��ʱ����2L���ܱ������У���Ӧ��ʼʱ����1mol CO2��1mol H2��2molCO��2mol H2O����Ӧ��__________���У�����������淽���ƶ�����