题目内容
MnO2是常见的氧化剂、催化剂和活性电极材料。
(1)工业上,以惰性材料为电极,电解MnSO4溶液(含少量稀硫酸)制备MnO2。写出阳极的电极反应式:___________。
(2)已知如下热化学方程式(K代表平衡常数):
①MnCO3(s) MnO(s)+CO2(g) △H1 K1
MnO(s)+CO2(g) △H1 K1
②2MnO(s)+O2(g) 2MnO2(s) △H2 K2
2MnO2(s) △H2 K2
③2MnCO3(s)+O2(g) 2MnO2(s)+2CO2(g) △H3 K3
2MnO2(s)+2CO2(g) △H3 K3
△H3=______(用△H1、△H2表示) K3=_______(用K1、K2表示)。
(3)反应②在低温条件下能自发进行,则△H2______0(填“>”“<”或“=”)。
(4)在密闭容器中投入足量的MnCO3,—定条件下发生反应:MnCO3(s) MnO(s)+CO2(g)
MnO(s)+CO2(g)
△H>0。在一定温度下,达到平衡状态时p(CO2)=2a MPa。

① 温度、压强对MnCO3分解率的影响如图所示:比较:L1____L2(填“>”“<”或“=”)。
② 保持温度不变,将容器体积扩大至原来的2倍,则p(CO2)的变化范围是______。
③ 保持温度不变,将容器体积压缩至原来的一半,达到新平衡时下列物理量-定不变的是__(填代号)。
A.平衡常数K B.c(CO2) C.n(CO2) D.m(MnCO3)
(5)—定温度下,在容积为2L的恒容密闭容器中加人足量的MnCO3(s)和5molO2,发生反应:2MnCO(s)+O2(g) 2MnO2(s)+2CO2(g),CO2以平均速率0.1mol• L-1·min-1经过10min达到平衡状态。该条件下该反应的平衡常数K为_______。
2MnO2(s)+2CO2(g),CO2以平均速率0.1mol• L-1·min-1经过10min达到平衡状态。该条件下该反应的平衡常数K为_______。
 阅读快车系列答案
阅读快车系列答案根据下列实验操作预测的实验现象正确的是
实验操作 | 预测的实验现象 | |
A | 向Na2CO3溶液中滴加盐酸 | 立即有气体逸出 |
B | 将浓硫酸滴加到盛有铜片的试管中,并将蘸有品红溶液的试纸置于试管口 | 试纸褪色 |
C | 铝箔在酒精灯火焰上加热 | 铝熔化但不会滴下 |
D | 向淀粉的水解液中加入新制Cu(OH)2悬浊液并加热 | 一定有砖红色沉淀生成 |
A. A B. B C. C D. D


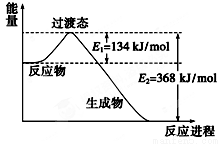
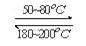 Ni(CO)4(g),
Ni(CO)4(g),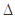 H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是________ (填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是________ (填字母编号)。 2CH3OH(l) △H=+24.52kJ/mol
2CH3OH(l) △H=+24.52kJ/mol

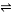 Z(g)+W(s) ΔH>0,下列叙述正确的是
Z(g)+W(s) ΔH>0,下列叙述正确的是

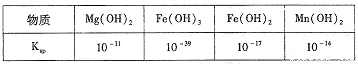






 该反应的化学方程式______________________;该反应________(填“属于”或“不属于”)氧化还原反应。
该反应的化学方程式______________________;该反应________(填“属于”或“不属于”)氧化还原反应。