题目内容
一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应: 3A(g)+B (g)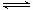 xC(g)。若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。请填写下列空白:
xC(g)。若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。请填写下列空白:
(1) x= ; 1min内,B的平均反应速率为_________;
(2)若反应经2min达到平衡,平衡时C的浓度_________0.8mol/L(填“大于”、“等于”或“小于”);
(3)平衡混合物中,C的体积分数为22%,若维持容器压强不变,达到平衡时C的体积分数_________22%,(填“大于”、“等于”或“小于”);
(4)若改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n (B)、n(C)之间应满足的关系式__________________ 。
(1)2 0.2 mol/(L·min); (2) 小于
(3)大于 (4) n(A)+3n(C)/2=3 n(B)+ n(C)/2=1。
【解析】
试题分析:
3A(g) + B (g) 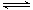 xC(g)
xC(g)
起始 3 1 0
转化 1.2 0.4 0.4×2=0.8
1min 1.8 0.6
所以x=2 B的平均反应速率为0.2 mol/(L·min)
(2)1min是C的浓度为0.4mol/L,2min平衡时随反应浓度降低,反应速率减慢,因此C的浓度小于0.8 mol/L。
(3)若维持容器压强不变,需要缩小容器体积,有利于反应正向移动,因此C的体积分数大于22%。
(4)根据等效平衡原理,需要满足:n(A)+3n(C)/2=3 n(B)+ n(C)/2=1。
考点:考查了化学平衡移动和计算。

 xC(g)。请填写下列空白:
xC(g)。请填写下列空白: