题目内容
【题目】下图是元素周期表的一部分
① | |||||||||||||||||
② | ③ | ④ | ⑤ | ||||||||||||||
⑥ | ⑦ | ⑧ | |||||||||||||||
⑨ | ⑩ |
(1)元素⑨的外围电子的电子排布图为________,元素⑩原子结构示意图为____________
(2)元素③④⑤的电负性由大到小的顺序为____________(填化学用语,下同),其第一电离能由大到小的顺序为_______________,其简单离子半径由大到小的顺序为_______________。
(3)如果在温度接近373K(100℃)时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是_________________。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质。写出元素②的最高价氧化物的水化物与NaOH溶液反应的离子方程式________________。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
元素代号 | I1 | I2 | I3 | I4 |
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一主族的是____________。(填元素代号)
②T元素最可能是______(填“s”、“p”、“d”、“ds”等)区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为________。
【答案】 ![]()
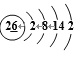 F>O>N F>N>O N3->O2->F- 分子间存在氢键,H2O分子发生缔合 2OH— + Be(OH)2 =BeO2 2—+ 2H2O R 和U p 120°
F>O>N F>N>O N3->O2->F- 分子间存在氢键,H2O分子发生缔合 2OH— + Be(OH)2 =BeO2 2—+ 2H2O R 和U p 120°
【解析】本题分析:本题主要考查元素周期表和元素的性质。
(1)元素⑨是钛,其外围电子排布图为![]() ,元素⑩为铁,其原子结构示意图为
,元素⑩为铁,其原子结构示意图为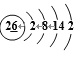 。
。
(2)元素③④⑤分别为碳、氮、氧,因为同周期元素从左到右,电负性逐渐增大,所以它们的电负性由大到小的顺序为F>O>N,因为同周期元素从左到右,第一电离能趋于增大,但是N的2p原子轨道处于半充满的较稳定状态,因而N的第一电离能大于氧,所以它们的第一电离能由大到小的顺序为F>N>O ,其简单离子半径的电子层结构相同,随着核电荷数的增大,离子半径逐渐减小,所以由大到小的顺序为N3->O2->F-。
(3)测定结果比理论值高,其原因是水分子间存在氢键,使得水分子发生缔合。
(4)元素②是铍,它的最高价氧化物的水化物Be(OH)2与NaOH溶液反应的离子方程式2OH-+Be(OH)2=BeO22-+2H2O。
(5)①Q的电离能较大,而且没有突跃,所以Q不易失去电子;R的第二电离能突跃,所以其化合价易呈+1;S的第三电离能突跃,所以其化合价易呈+2;T的第四电离能突跃,所以其化合价易呈+3;U的第二电离能突跃,所以其化合价易呈+1。同一主族元素的主要化合价相同。因此,在周期表中,最可能处于同一主族的是R 和U。
②T原子易失去3个电子,最可能是最外层有3个电子,其中2个s电子,1个p电子,所以T元素最可能是p区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z分别为硼、氯,它们形成的化合物BCl3分子中的中心原子B的价层电子对为3,分子呈平面正三角形,键角为120°。

 名校课堂系列答案
名校课堂系列答案

