题目内容
一定温度下2 L的恒容容器甲中,加入2 mol碳和2 mol CO2发生如下反应: C(s)+CO2(g)  2CO(g) ΔH>0,测得容器中CO2的物质的量随时间t的变化关系如图所示。
2CO(g) ΔH>0,测得容器中CO2的物质的量随时间t的变化关系如图所示。
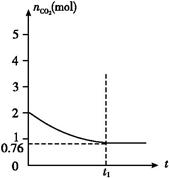
(1)该反应的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(2)列式并计算上述温度下此反应的平衡常数 (结果保留一位小数)。
(3)向上述平衡体系中再通入CO2,则CO2的转化率 (填“增大”、“减小”、“不变”或“无法确定”)。
(4)相同温度下,2 L的恒容容器乙中加入4 mol碳和4 mol CO2,达到平衡。请在图中画出乙容器中CO2的物质的量随时间t变化关系的预期结果示意图。(注明平衡时CO2的物质的量)
(5)相同温度下,2 L的恒容容器丙中加入4 mol碳、4 mol CO2和4 mol CO。开始反应时v正 v逆(填“>”、“<”或“=”)。
 2CO(g) ΔH>0,测得容器中CO2的物质的量随时间t的变化关系如图所示。
2CO(g) ΔH>0,测得容器中CO2的物质的量随时间t的变化关系如图所示。
(1)该反应的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(2)列式并计算上述温度下此反应的平衡常数 (结果保留一位小数)。
(3)向上述平衡体系中再通入CO2,则CO2的转化率 (填“增大”、“减小”、“不变”或“无法确定”)。
(4)相同温度下,2 L的恒容容器乙中加入4 mol碳和4 mol CO2,达到平衡。请在图中画出乙容器中CO2的物质的量随时间t变化关系的预期结果示意图。(注明平衡时CO2的物质的量)
(5)相同温度下,2 L的恒容容器丙中加入4 mol碳、4 mol CO2和4 mol CO。开始反应时v正 v逆(填“>”、“<”或“=”)。
(1)> 较高
(2)K=c2(CO)/c(CO2)=1.242/0.38≈4.0
(3)减小
(4)

(5)>
(2)K=c2(CO)/c(CO2)=1.242/0.38≈4.0
(3)减小
(4)

(5)>
(1)根据方程式可知,该反应是熵值增加的,由于反应是吸热反应,根据ΔG=ΔH-TΔS,要使该反应自发进行,ΔG<0,则需要在高温下。
(2)平衡时CO2的物质的量是0.76 mol,则消耗CO2是(2-0.76) mol="1.24" mol,所以生成CO是2.48 mol,因此CO2和CO的浓度分别是0.38 mol/L和1.24 mol/L,所以K=c2(CO)/c(CO2)=1.242/0.38≈4.0。
(3)增大CO2的浓度,则平衡向正反应方向移动,但CO2的转化率降低。
(4)由于CO2的浓度增大,所以反应速率加快,达到平衡的时间减少。设消耗CO2 x mol,则生成CO为2x mol,所以有K=c2(CO)/c(CO2)=x2/(2-0.5x)=4.0,解得x="2" mol,据此可画出示意图。
(5)由于此时c2(CO)/c(CO2)=22/2=2<4.0,所以反应向正反应方向移动,则正反应速率大于逆反应速率。
(2)平衡时CO2的物质的量是0.76 mol,则消耗CO2是(2-0.76) mol="1.24" mol,所以生成CO是2.48 mol,因此CO2和CO的浓度分别是0.38 mol/L和1.24 mol/L,所以K=c2(CO)/c(CO2)=1.242/0.38≈4.0。
(3)增大CO2的浓度,则平衡向正反应方向移动,但CO2的转化率降低。
(4)由于CO2的浓度增大,所以反应速率加快,达到平衡的时间减少。设消耗CO2 x mol,则生成CO为2x mol,所以有K=c2(CO)/c(CO2)=x2/(2-0.5x)=4.0,解得x="2" mol,据此可画出示意图。
(5)由于此时c2(CO)/c(CO2)=22/2=2<4.0,所以反应向正反应方向移动,则正反应速率大于逆反应速率。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 CO2+H2在724℃达到平衡时,分别改变下列条件,K值发生变化的是
CO2+H2在724℃达到平衡时,分别改变下列条件,K值发生变化的是 pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是 ( )。
pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是 ( )。 CH3OH(g)在一密闭容器中达到平衡。充入适量氢气,增大容器的体积,维持H2的浓度和容器的温度不变,跟原平衡相比较达到新平衡时CO的转化率将( )
CH3OH(g)在一密闭容器中达到平衡。充入适量氢气,增大容器的体积,维持H2的浓度和容器的温度不变,跟原平衡相比较达到新平衡时CO的转化率将( ) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )。
达到平衡时,温度和压强对该反应的影响如图所示:图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )。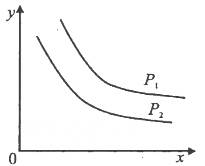
 CH3OH(g)。
CH3OH(g)。